Lý thuyết Nguyên tố nhóm IIA (Hóa 12 Chân trời sáng tạo Bài 18)
Với tóm tắt lý thuyết Hóa 12 Bài 18: Nguyên tố nhóm IIA sách Chân trời sáng tạo hay nhất, chi tiết sẽ giúp học sinh lớp 12 nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 12.
Lý thuyết Nguyên tố nhóm IIA (Hóa 12 Chân trời sáng tạo Bài 18)
(199k) Xem Khóa học Hóa 12 CTST
A. ĐƠN CHẤT
I. VỊ TRÍ CẤU TẠO VÀ TRẠNG THÁI TỰ NHIÊN
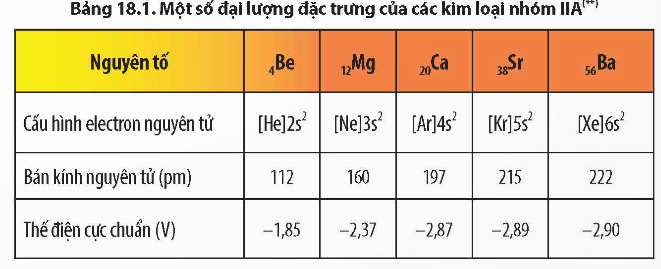
- Các nguyên tố nhóm IIA gồm, beryllium (Be), magnesium (Mg), calcium (Ca), strontium (Sr), barium (Ba) và radium (Ra).
- Kim loại nhóm IIA là các nguyên tố hoạt động hoá học mạnh và không tìm thấy ở dạng đơn chất trong tự nhiên.
- Một số quặng của nguyên tố kim loại nhóm IIA:
+ Magnesium tồn tại trong quặng dolomite (CaCO3. MgCO3)
+ Calcium có trong đá vôi (CaCO3), dolomite, thạch cao (CaSO4).
II. TÍNH CHẤT VẬT LÍ
- Sự biến đổi nhiệt độ nóng chảy của kim loại nhóm IIA không theo quy luật do cấu trúc mạng tinh thể của kim loại nhóm IIA khác nhau.
- Nhiệt độ nóng chảy, khối lượng riêng và độ cứng của kim loại nhóm IIA cao hơn so với kim loại nhóm IA cùng chu kì. Kim loại nhóm IIA là những kim loại nhẹ (D < 5g/ cm3).
III. TÍNH CHẤT HÓA HỌC
- Kim loại nhóm IIA có tính khử mạnh, tính khử tăng dần từ Be đến Ba.
- Từ Be đến Ba, điện tích hạt nhân tăng, bán kính nguyên tử tăng nhanh, vì vậy tính kim loại tăng. Trạng thái oxi hoá phổ biến trong các hợp chất của kim loại nhóm IIA là + 2.
1. Phản ứng với oxygen
- Khi đốt nóng, kim loại nhóm IIA cháy trong không khí tạo các oxide, phản ứng tỏa nhiều nhiệt:
- Mg cháy phát ra ánh sáng chói, giàu tia tử ngoại nên được ứng dụng làm pháo sáng.
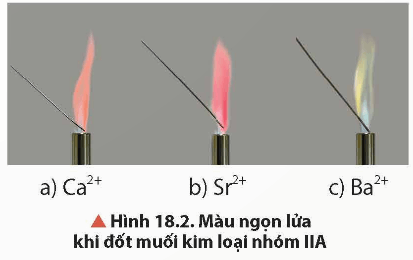
- Có thể nhận biết đơn chất và các hợp chất của Ca2+, Sr2+, Ba2+ bằng phương pháp thử màu ngọn lửa.
+ Đơn chất và hợp chất của Ca2+ cháy cho ngọn lửa màu đỏ cam.
+ Đơn chất và hợp chất của Sr2+ cháy cho ngọn lửa màu đỏ son.
+ Đơn chất và hợp chất của Ba2+ cháy cho ngọn lửa màu lục.
2. Phản ứng với nước
- Berrylium không tác dụng với nước và hơi nước do có màng oxide bền bảo vệ bề mặt. - Các kim loại Ca, Sr, Ba khử H2O ở nhiệt độ thường.
- Magnesium phản ứng chậm với nước ở nhiệt độ thường và phản ứng nhanh hơn khi đun nóng.
- Độ tan của các hydroxide trong nước tăng theo thứ tự:
B. HỢP CHẤT
I. TÍNH CHẤT CỦA MUỐI CARBONATE, NITRATE
1. Tương tác của muối carbonate với dung dịch acid loãng, với nước khi có mặt CO2
Muối carbonate tác dụng với dung dịch acid loãng, phản ứng với H₂O khi có mặt CO2:
2. Sự phân hủy nhiệt của muối carbonate và muối nitrate
- Dưới tác dụng của nhiệt, muối carbonate của kim loại nhóm IIA bị phân huỷ tạo thành oxide.
- Khi đun nóng, muối nitrate của kim loại nhóm IIA phân huỷ thành oxide.
- Độ bền nhiệt của muối carbonate, muối nitrate của kim loại nhóm IIA có xu hướng tăng dần từ muối của Mg2+ đến muối của Ba2+.
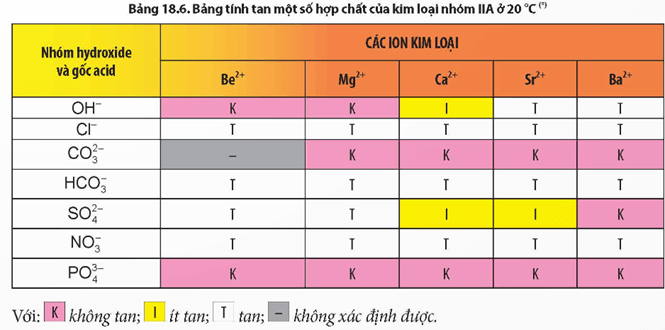
II. TÍNH TAN CỦA CÁC MUỐI CARBONATE, SULFATE,NITRATE
- Các muối nitrate đều tan.
- Trừ BeCO3, các muối carbonate khác không tan trong nước.
- Các muối BeSO4, MgSO4 tan; SrSO4 và CaSO4 ít tan; BaSO4 không tan.
Chú ý: CaSO4 có độ tan lớn hơn BaSO4.
- Nhận biết các ion: trong dung dịch:
III. ỨNG DỤNG
Một số ứng dụng của đơn chất và hợp chất kim loại nhóm IIA:
- Magnesium: Mg nhẹ hơn so với Al, vì vậy hợp kim của Mg được sử dụng trong chế tạo máy bay, ô tô,...
- Đá vôi: có thành phần chính là calcium carbonate, được dùng để sản xuất vôi, xi măng, làm vật liệu xây dựng....
- Vôi sống (calcium oxide) làm vật liệu xây dựng, tẩy uế, sát trùng.
- Nước vôi (calcium hydroxide) được dùng trong xử lí nước, giảm tính cứng của nước.
- Thạch cao có thành phần chính là calcium sulfate (CaSO4.nH₂O), được sử dụng làm vách, trần thạch cao để tăng tính thẩm mĩ trong xây dựng. Trong lĩnh vực y tế, thạch cao thường được ứng dụng trong kĩ thuật bó bột định hình xương.
- Khoáng vật apatite chứa calcium, công thức Ca5(PO4)3F, Ca5(PO4)3OH và Ca5(PO4)3Cl, được dùng chế tạo phân bón cho nông nghiệp, làm nguyên liệu sản xuất phân lân.
- Vai trò một số hợp chất của calcium trong cơ thể con người: Calcium là thành phần chính của xương và răng; ion calcium có trong muối phosphate phức tạp, hydroxyapatite, Ca5(PO4)3OH. Ion Ca2+ trong cơ thể người có chức năng kích hoạt quá trình trao đổi chất, đóng vai trò quan trọng trong hoạt động của tim, đông máu, co cơ và truyền xung thần kinh.
IV. NƯỚC CỨNG VÀ CÁCH LÀM MỀM NƯỚC CỨNG
1. Phân loại nước cứng
- Nước cứng là loại nước có chứa ion Ca2+ và Mg2+ với hàm lượng vượt quá mức cho phép.
- Nước có tính cứng tạm thời là nước cứng chứa ion , (muối Ca(HCO3)2; Mg(HCO3)2).
- Nước có tính cứng vĩnh cửu là nước cứng chứa các ion (muối MgCl2, CaCl2, MgSO4, CaSO4).
- Nước có tính cứng toàn phần là loại nước cứng bao gồm cả tính cứng tạm thời và tính cứng vĩnh cửu.
2. Tác hại của nước cứng
- Trong đời sống hàng ngày: Nước cứng làm giảm khả năng tạo bọt của xà phòng, giảm tác dụng giặt rửa, làm các dụng cụ đun nấu dễ bị đóng cặn, tiêu hao năng lượng. Nếu sử dụng nước cứng để nấu ăn sẽ làm thực phẩm lâu chín và giảm mùi vị.
- Trong bảo vệ sức khoẻ: Dùng nước cứng tắm gội hàng ngày sẽ gây khô da, khô tóc hay mẩn ngứa, gây hại sức khoẻ.
- Trong công nghiệp: Trong các nồi áp suất của tua bin hơi nước ở nhiều nhà máy, nước cứng tạo cặn là CaCO3, cản trở quá trình dẫn nhiệt. Các mảng bám còn tăng nguy cơ tắc ống, tắc lỗ van an toàn gây nguy hiểm.
3. Phương pháp làm mềm nước cứng
Nguyên tắc làm mềm nước cứng là làm giảm nồng độ các ion Ca2+ và Mg2+ trong nước cứng.
a) Phương pháp kết tủa
Bằng cách chuyển ion Ca2+ và ion Mg2+ thành dạng kết tủa, thường là CaCO3, MgCO3, Ca3(PO4)2, Mg3(PO4)2.
*Đối với nước có tính cứng tạm thời:
- Đun sôi nước, ion Ca2+ và Mg2+ sẽ tách ra dưới dạng kết tủa.
- Dùng lượng vừa đủ dung dịch Ca(OH)2 để phản ứng với muối Ca(HCO3)2; Mg(HCO3)2.
- Cho phản ứng với dung dịch chứa ion hoặc :
*Đối với nước có tính cứng vĩnh cửu
Cách phổ biến là thêm ion hoặc vào dung dịch:
b) Phương pháp trao đổi ion
Phương pháp này dựa trên việc trao đổi ion Ca2+ và Mg2+ bằng các ion như Na+ hay H+ trên vật liệu zeolite. Khi nước cứng đi qua vật liệu zeolite, các ion Ca2+ và Mg2+ bị giữ lại, ion Na+ hay H+ trong zeolite đi vào dung dịch.
(199k) Xem Khóa học Hóa 12 CTST
Xem thêm tóm tắt lý thuyết Hóa học lớp 12 Chân trời sáng tạo hay khác:
Xem thêm các tài liệu học tốt lớp 12 hay khác:
- Giải sgk Hóa học 12 Chân trời sáng tạo
- Giải Chuyên đề học tập Hóa 12 Chân trời sáng tạo
- Giải SBT Hóa học 12 Chân trời sáng tạo
- Giải lớp 12 Chân trời sáng tạo (các môn học)
- Giải lớp 12 Kết nối tri thức (các môn học)
- Giải lớp 12 Cánh diều (các môn học)
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 12 (hay nhất) - CTST
- Soạn văn 12 (ngắn nhất) - CTST
- Giải sgk Toán 12 - CTST
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Giải sgk Vật Lí 12 - CTST
- Giải sgk Hóa học 12 - CTST
- Giải sgk Sinh học 12 - CTST
- Giải sgk Lịch Sử 12 - CTST
- Giải sgk Địa Lí 12 - CTST
- Giải sgk Giáo dục KTPL 12 - CTST
- Giải sgk Tin học 12 - CTST
- Giải sgk Hoạt động trải nghiệm 12 - CTST
- Giải sgk Âm nhạc 12 - CTST

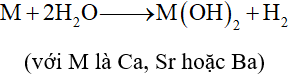





 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

