Lý thuyết Sự ăn mòn kim loại (Hóa 12 Kết nối tri thức Bài 22)
Với tóm tắt lý thuyết Hóa 12 Bài 22: Sự ăn mòn kim loại sách Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh lớp 12 nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 12.
Lý thuyết Sự ăn mòn kim loại (Hóa 12 Kết nối tri thức Bài 22)
(199k) Xem Khóa học Hóa 12 KNTT
I. ĂN MÒN KIM LOẠI
1. Khái niệm
Ăn mòn kim loại là sự phá huỷ kim loại hoặc hợp kim dưới tác dụng của các chất trong môi trường, trong đó kim loại bị oxi hoá.
Ví dụ:
- Thép để lâu ngoài không khí ẩm thường tạo thành gỉ sắt có màu nâu đỏ;
- Vật bằng đồng để lâu trong tự nhiên có thể tạo thành gỉ đồng màu xanh.
2. Các dạng ăn mòn kim loại trong tự nhiên
Tuỳ theo cơ chế của sự ăn mòn, người ta chia ăn mòn kim loại thành hai loại: ăn mòn hoá học và ăn mòn điện hoá.
a) Ăn mòn hoá học
Khi để kim loại trong không khí, có thể xảy ra hiện tượng ăn mòn hoá học. Nguyên nhân của hiện tượng trên là do xảy ra phản ứng oxi hoá - khử trực tiếp giữa kim loại với các chất oxi hoá có trong môi trường.
Ví dụ: Bộ phận của thiết bị lò đốt bằng sắt bị ăn mòn bởi khí oxygen:
3Fe(s) + 2O2(g) Fe3O4(s)
b) Ăn mòn điện hoá
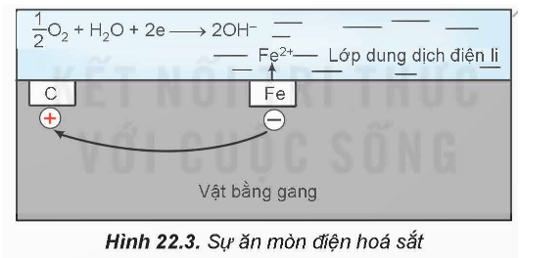
- Sự ăn mòn điện hoá kim loại xảy ra khi có sự tạo thành pin điện.
Ví dụ: Sự ăn mòn điện hoá kim loại trong không khí ẩm.
Trong không khí ẩm, trên bề mặt của gang thép luôn có một lớp nước mỏng đã hoà tan khí oxygen và carbon dioxide tạo thành dung dịch chất điện li. Sắt và các thành phần khác (chủ yếu là carbon) cùng tiếp xúc với dung dịch đó, tạo nên vô số pin điện hoá rất nhỏ mà anode là sắt và cathode là carbon.
Ở anode, xảy ra quá trình oxi hoá:
Fe(s) Fe2+(aq) + 2e
Ở cathode, xảy ra quá trình khử:
Fe2+ tiếp tục bị oxi hoá bởi oxygen không khí, tạo thành gỉ sắt có thành phần chính là Fe2O3.nH2O.
- Điều kiện của quá trình ăn mòn điện hoá: Hai kim loại khác nhau hoặc một kim loại và một phi kim; Chúng tiếp xúc với nhau trực tiếp hoặc gián tiếp thông qua dây dẫn điện và cùng tiếp xúc với một dung dịch chất điện li.
II. CHỐNG ĂN MÒN KIM LOẠI
Có hai phương pháp phổ biến bảo vệ kim loại khỏi bị ăn mòn là phương pháp điện hoá và phương pháp phủ bề mặt.
1. Phương pháp điện hoá
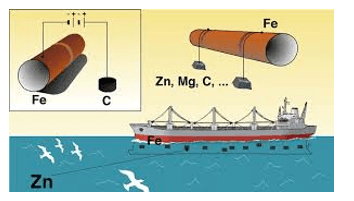
Nguyên tắc bảo vệ kim loại khỏi bị ăn mòn bằng phương pháp điện hoá là gắn lên kim loại cần bảo vệ một kim loại khác hoạt động hoá học mạnh hơn. Khi đó, kim loại hoạt động hoá học mạnh hơn bị ăn mòn.
Ví dụ: Để bảo vệ tàu biển làm bằng thép, người ta gắn các tấm kẽm lên vỏ tàu (phần chìm dưới nước).
2. Phương pháp phủ bề mặt
Phương pháp phủ bề mặt ngăn kim loại tiếp xúc trực tiếp với môi trường bằng cách:
- Phủ kim loại cần bảo vệ bằng các kim loại khác không bị gỉ như Au, Sn, Zn.
Ví dụ: Vỏ đồng hồ mạ vàng; tráng thiếc lên lá thép (sắt tây); tráng kẽm lên lá thép (tôn).
- Phủ kim loại cần bảo vệ bằng các hợp chất vô cơ hoặc hữu cơ như sơn, dầu, mỡ,...
Ví dụ: Các đồ vật bằng sắt thường được sơn hoặc tra dầu, mỡ.
(199k) Xem Khóa học Hóa 12 KNTT
Xem thêm tóm tắt lý thuyết Hóa học lớp 12 Kết nối tri thức hay khác:
Xem thêm các tài liệu học tốt lớp 12 hay khác:
- Giải sgk Hóa học 12 Kết nối tri thức
- Giải Chuyên đề học tập Hóa 12 Kết nối tri thức
- Giải SBT Hóa học 12 Kết nối tri thức
- Giải lớp 12 Kết nối tri thức (các môn học)
- Giải lớp 12 Chân trời sáng tạo (các môn học)
- Giải lớp 12 Cánh diều (các môn học)
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT

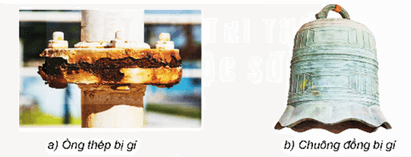





 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

