Lý thuyết Một số tính chất và ứng dụng của phức chất (Hóa 12 Kết nối tri thức Bài 29)
Với tóm tắt lý thuyết Hóa 12 Bài 29: Một số tính chất và ứng dụng của phức chất sách Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh lớp 12 nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 12.
Lý thuyết Một số tính chất và ứng dụng của phức chất (Hóa 12 Kết nối tri thức Bài 29)
(199k) Xem Khóa học Hóa 12 KNTT
I. MỘT SỐ DẤU HIỆU CỦA PHẢN ỨNG TẠO PHỨC CHẤT VÀ PHẢN ỨNG THẾ PHỐI TỬ CỦA PHỨC CHẤT TRONG DUNG DỊCH
1. Một số dấu hiệu của phản ứng tạo phức chất trong dung dịch
- Phản ứng tạo phức chất trong dung dịch có thể được nhận biết dựa vào một số dấu hiệu như: xuất hiện kết tủa; hòa tan kết tủa; thay đổi màu sắc.
- Ví dụ:
+ Nhỏ vài giọt dung dịch NaOH vào ống nghiệm chứa dung dịch AlCl3, thấy xuất hiện kết tủa, chứng tỏ phức chất [Al(OH)3(H2O)3] đã được tạo thành.
+ Nhỏ vài giọt dung dịch NaCl vào ống nghiệm chứa dung dịch AgNO3, thu được kết tủa trắng AgCl. Tiếp tục nhỏ vào ống nghiệm dung dịch NH3 đến dư thấy kết tủa tan, chứng tỏ phức chất [Ag(NH3)2]+ đã được tạo thành.
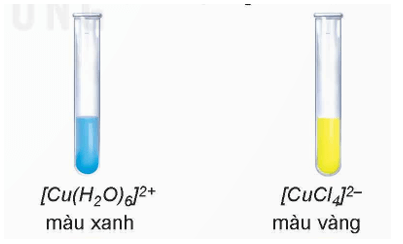
+ Nhỏ vài giọt dung dịch HCl đặc vào ống nghiệm chứa dung dịch CuSO4 loãng thấy dung dịch từ màu xanh chuyển sang màu vàng, chứng tỏ phức chất [CuCl4]2- đã được tạo thành.
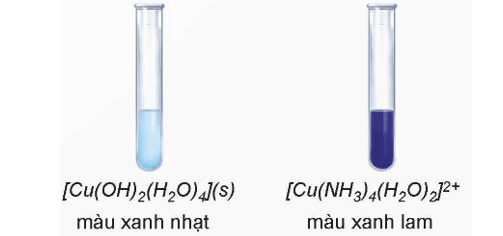
+ Nhỏ vài giọt dung dịch NH3 vào dung dịch CuSO4 loãng thấy xuất hiện kết tủa màu xanh nhạt, chứng tỏ phức chất [Cu(OH)2(H2O)4] đã được tạo thành. Tiếp tục nhỏ vào ống nghiệm dung dịch NH3 đến dư thấy kết tủa tan, đồng thời dung dịch chuyển sang màu xanh lam, chứng tỏ phức chất [Cu(NH3)4(H2O)2]2+ đã được tạo thành.
*Mở rộng:
- Các phức chất mang điện như [Co(NH3)6]3+, [Zn(OH)4]2- thường tan tốt trong nước, còn các phức chất không mang điện (phức chất trung hòa) như [Fe(CO)5], [PtCl2(NH3)2] thường ít tan trong nước.
- Màu sắc đặc trưng của một số dung dịch phức chất kim loại chuyển tiếp dãy thứ nhất được cho bằng bảng sau
|
Phức chất |
Màu sắc |
Phức chất |
Màu sắc |
|
[Cr(H2O)6]3+ |
Xanh tím |
[Cr(OH)6]3- |
Xanh rêu |
|
[Fe(H2O)6]2+ |
Lục nhạt |
[Fe(H2O)6]3+ |
Vàng nhạt |
|
[Co(H2O)6]2+ |
Hồng đỏ |
[Co(NH3)6]2+ |
Vàng nâu |
2. Sự tạo thành phức chất của ion kim loại chuyển tiếp và phản ứng thế phối tử của phức chất trong dung dịch
a) Sự tạo thành phức chất của Cu2+ trong dung dịch
Thí nghiệm: Sự tạo thành phức chất của Cu2+
Chuẩn bị:
Hoá chất: dung dịch CuSO4 5%, dung dịch NaOH 10%, dung dịch NH3 10%, dung dịch HCl đặc.
Dụng cụ: ống nghiệm.
Tiến hành:
– Cho khoảng 1 mL dung dịch CuSO4 5% vào ống nghiệm (1). Cho tiếp 3 giọt dung dịch NaOH 10% vào ống nghiệm, lắc đều. Nhỏ từ từ dung dịch NH3 10% vào ống nghiệm, vừa nhỏ vừa lắc đều đến khi kết tủa tan hoàn toàn.
– Cho khoảng 1 mL dung dịch CuSO4 5% vào ống nghiệm (2). Nhỏ từ từ dung dịch HCl đặc vào ống nghiệm, vừa nhỏ vừa lắc đều đến khi dung dịch chuyển màu hoàn toàn.
Hiện tượng và viết phương trình hoá học của các phản ứng xảy ra:
Ống nghiệm 1:
- Ban đầu xuất hiện kết tủa xanh:
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4.
- Sau đó kết tủa xanh tan dần tạo thành phức chất có màu xanh lam:
Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2.
Ống nghiệm 2:
- Dung dịch chuyển từ màu xanh sang xanh lá, cuối cùng là màu vàng:
CuSO4 + 4HCl → H2[CuCl4] + H2SO4
Các em HS tham khảo video thí nghiệm tại đây: https://www.youtube.com/watch?v=g_U1VYWFRtI
b) Phản ứng thế phối tử của phức chất trong dung dịch
- Các phối tử trong phức chất có thể bị thế bởi các phối tử khác. Quá trình xảy ra sự thế phối tử này bởi phối tử khác được gọi là phản ứng thế phối tử của phức chất. Quá trình này xảy ra thuận lợi khi phức chất mới được hình thành bền hơn phức chất ban đầu.
- Ví dụ:
[PtCl4]2-(aq) + NH3(aq) → [PtCl3(NH3)]-(aq) + Cl-(aq)
Ở phản ứng này, một phối tử Cl- trong phức chất [PtCl4]2- bị thế bởi một phối tử NH3, tạo ra phức chất [PtCl3(NH3)]-.
[Fe(H2O)6]2+(aq) + 6CN-(aq) → [Fe(CN)6]4-(aq) + 6 H2O(l)
Ở phản ứng này, các phối tử H2O trong phức chất [Fe(H2O)6]2+ bị thay thế bởi phối tử CN-, tạo ra phức chất [Fe(CN)6]4-.
II. MỘT SỐ ỨNG DỤNG CỦA PHỨC CHẤT
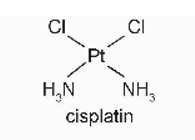
- Trong y học, nhiều phức chất có khả năng chữa trị hoặc kiểm soát bệnh.
Ví dụ: Phức chất được dùng làm thuốc chữa bệnh ung thư với tên gọi thương phẩm là cisplatin có cấu tạo như sau:
- Trong công nghiệp hóa chất, nhiều hợp chất hóa học được điều chế khi có mặt chất xúc tác là phức chất.
Ví dụ: Phản ứng ghép mạch carbon sử dụng xúc tác là phức chất [Pd(P(C6H5)3)4].
- Trong hóa học, phức chất được dùng để nhận biết và xác định hàm lượng các ion kim loại chuyển tiếp trong dung dịch.
Ví dụ: Phức chất [Ag(NH3)2]+ để phân biệt aldehyde và keton.
- Ba phức chất sinh học (còn gọi là các phân tử sinh học chứa kim loại) phổ biến và thiết yếu đối với cuộc sống là:
+ Phức chất của Mg2+ cấu tạo nên chlorophyll hay chất diệp lục, có vai trò quan trọng trong quá trình quang hợp của cây xanh, thực vật có màu xanh là do có chứa chlorophyll.
+ Phức chất của Fe2+ cấu tạo nên nhân heme, thành phần của hemoglobin hay còn gọi là huyết sắc tố, viết tắt là Hb hay Hgb, là thành phần cấu tạo nên hồng cầu của máu. Trong hệ thống tim mạch, heme có vai trò chính trong việc vận chuyển và tích lũy oxygen trong cơ thể. Hồng cầu có màu đỏ là do có chứa nhân heme.
+ Phức chất có chứa Co3+ cấu tạo nên vitamin B12, có vai trò thiết yếu trong việc hình thành tế bào hồng cầu, chuyển hóa tế bào, chức năng thần kinh và sản xuất DNA.
(199k) Xem Khóa học Hóa 12 KNTT
Xem thêm tóm tắt lý thuyết Hóa học lớp 12 Kết nối tri thức hay khác:
Xem thêm các tài liệu học tốt lớp 12 hay khác:
- Giải sgk Hóa học 12 Kết nối tri thức
- Giải Chuyên đề học tập Hóa 12 Kết nối tri thức
- Giải SBT Hóa học 12 Kết nối tri thức
- Giải lớp 12 Kết nối tri thức (các môn học)
- Giải lớp 12 Chân trời sáng tạo (các môn học)
- Giải lớp 12 Cánh diều (các môn học)
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

