Lý thuyết Nguyên tố nhóm IIA (Hóa 12 Kết nối tri thức Bài 25)
Với tóm tắt lý thuyết Hóa 12 Bài 25: Nguyên tố nhóm IIA sách Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh lớp 12 nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 12.
Lý thuyết Nguyên tố nhóm IIA (Hóa 12 Kết nối tri thức Bài 25)
(199k) Xem Khóa học Hóa 12 KNTT
I. ĐƠN CHẤT NHÓM IIA
1. Đặc điểm chung
- Kim loại nhóm IIA là những nguyên tố s, đứng ngay sau nguyên tố kim loại kiềm ở mỗi chu kì.
- Kim loại nhóm IIA có thể điện cực chuẩn nhỏ nên dễ tách electron hoá trị ra khỏi nguyên tử, thể hiện tính khử mạnh:
M → M2+ + 2e
- Trong hợp chất, nguyên tử nhóm IIA thể hiện số oxi hoá đặc trưng là +2.
- Một số đại lượng đặc trưng của các nguyên tố nhóm IIA:
|
Nguyên tử |
Số hiệu nguyên tử |
Tên gọi |
Cấu hình electron |
Bán kính nguyên tử (pm) |
Thế điện cực chuẩn, V |
|
Be |
4 |
Beryllium |
[He]2s2 |
112 |
-1,99 |
|
Mg |
12 |
Magnesium |
[Ne]3s2 |
160 |
-2,356 |
|
Ca |
20 |
Calcium |
[Ar]4s2 |
197 |
-2,84 |
|
Sr |
38 |
Strontium |
[Kr]5s2 |
215 |
-2,89 |
|
Ba |
56 |
Barium |
[Xe]6s2 |
222 |
-2,92 |
2. Trạng thái tự nhiên
Trong tự nhiên, các nguyên tố nhóm IIA chỉ tồn tại ở dạng hợp chất. Magnesium và calcium là hai nguyên tố phổ biển trên vỏ Trái Đất, có trong nhiều khoáng vật như MgCO3.CaCO3 (dolomite), CaCO3 (calcite), Ca3(PO4)2 (phosphorite),...
3. Tính chất vật lí
- Kim loại nhóm IIA có nhiệt độ nóng chảy cao hơn nhiệt độ nóng chảy của kim loại nhóm IIA, nhưng tương đối thấp so với nhiệt độ nóng chảy của các kim loại khác.
- Kim loại nhóm IIA đều là kim loại nhẹ, có khối lượng riêng tương đối nhỏ.
- Một số thông số vật lí của kim loại nhóm IIA:
|
Kim loại |
Nhiệt độ nóng chảy (˚C) |
Nhiệt độ sôi (˚C) |
Khối lượng riêng (g/cm3) |
|
Be |
1287 |
2467 |
1,85 |
|
Mg |
651 |
1100 |
1,74 |
|
Ca |
842 |
1484 |
1,55 |
|
Sr |
757 |
1366 |
2,64 |
|
Ba |
727 |
1845 |
3,51 |
- Cấu trúc tinh thể kim loại nhóm IIA: Berylium và magnesium có cấu trúc lục phương chặt khít; calcium và strontium có cấu trúc lập phương tâm mặt; barium có cấu trúc lập phương tâm khối.
4. Tính chất hoá học
Kim loại nhóm IIA là các kim loại có tính khử mạnh, chỉ kém kim loại nhóm IA.
a) Tác dụng với oxygen
- Ở điều kiện thường, trong không khí beryllium bền do có lớp màng oxide bảo vệ, magesium bị oxi hoá chậm, các kim loại khác bị oxi hoá nhanh tạo thành oxide, bề mặt kim loại chuyển dần sang màu xám.
- Khi đốt nóng trong không khí, beryllium phản ứng chậm với oxygen, các kim loại khác phản ứng mạnh với oxygen cho màu ngọn lửa đặc trưng (calcium cho màu đỏ cam, strontium cho màu đỏ son, barium cho màu lục).
b) Tác dụng với nước
- Khả năng và mức độ tác dụng với nước của kim loại nhóm IIA:
|
Kim loại |
Đặc điểm |
|
Be |
Không tác dụng với nước. |
|
Mg |
Phản ứng chậm với nước ở nhiệt độ thường, nhanh hơn khi đun nóng: Mg + 2H2O → Mg(OH)2 + H2 |
|
Ca, Sr, Ba |
Tác dụng mạnh với nước ở ngay nhiệt độ thường. Ví dụ: Ca + 2H2O → Ca(OH)2 + H2 |
- Trong phản ứng của kim loại nhóm IIA với nước, sản phẩm tạo thành càng dễ tan thì càng dễ giải phóng khỏi bề mặt kim loại, tạo điều kiện để kim loại tiếp tục phản ứng với nước.
- Độ tan trong nước của các hydroxide nhóm IIA ở 20°C cho trong bảng sau:
|
Hdroxide |
Mg(OH)2 |
Ca(OH)2 |
Sr(OH)2 |
Ba(OH)2 |
|
Độ tan (g/100g nước) |
1,25.10-3 |
0,173 |
1,77 |
3,89 |
5. Ứng dụng
Các kim loại nhóm IIA và hợp kim của chúng có nhiều ứng dụng trong thực tế: Be dùng để chế tạo hợp kim có độ bền cơ học, không bị ăn mòn, khó nóng chảy,.. Mg dùng để chế tạo hợp kim làm vật liệu sản xuất ô tô, máy bay, chi tiết máy, …
II. Hợp chất của kim loại nhóm IIA
1. Đặc điểm chung
- Sự phân loại tính tan các chất dựa vào độ tan (g/100 gam nước) của chúng như sau:
- Tính tan trong nước của một số hợp chất nhóm IIA được trình bày như sau:
|
Anion |
Cation |
|||
|
Mg2+ |
Ca2+ |
Sr2+ |
Ba2+ |
|
|
CO32- |
K |
K |
K |
K |
|
SO42- |
T |
I |
I |
K |
|
NO3- |
T |
T |
T |
T |
|
OH- |
K |
I |
T |
T |
T : chất dễ tan; I : chất ít tan; K: chất không tan
- Tương tự kim loại nhóm IIA, đốt nóng các kim loại nhóm IIA hoặc hợp chất của chúng trong ngọn lửa không màu làm ngọn lửa có màu đặc trưng: Ca2+ màu đỏ cam, Sr2+ màu đỏ son, Ba2+ màu lục.
2. Một số hợp chất quan trọng
a) Muối carbonate và nitrate
- Tác dụng với acid:
+ Muối carbonate của kim loại nhóm IIA là muối của acid yếu, tác dụng được với nhiều acid vô cơ và hữu cơ, giải phóng khí carbon dioxide.
+ Muối carbonate của kim loại nhóm IIA tan dần trong nước có hòa tan khí carbon dioxide.
Ví dụ: CaCO3 + CO2 + H2O ⇌ Ca(HCO3)2
- Phản ứng nhiệt phân:
Tương tự muối carbonate, các muối nitrate của kim loại nhóm IIA cũng đều bị phân hủy nhiệt tạo thành oxide.
MCO3(s) MO (s) + CO2 (g)
b) Nhận biết từng ion riêng rẽ Ca2+, Ba2+, SO42-, CO32- trong dung dịch
Để nhận biết sự có mặt của mỗi ion Ca2+, Mg2+, trong dung dịch, người ta quan sát các hiện tượng xảy ra (như sự xuất hiện kết tủa, sủi bọt khí …) khi cho các chất phù hợp vào dung dịch.
3. Ứng dụng
Các nguyên, vật liệu chứa calcium như đá vôi, vôi, nước vôi, thạch cao, quặng apatite, quặng fluorite, … có nhiều ứng dụng trong đời sống và sản xuất:
|
Nguyên, vật liệu |
Ứng dụng |
|
Đá vôi |
Sản xuất vôi sống, xi măng, vật liệu xây dựng, … |
|
Vôi sống |
Khử chua; sát trùng, tẩy uế; hút ẩm trong công nghiệp, … |
|
Vôi, nước vôi |
Khử chua, làm mềm nước cứng, … |
|
Thạch cao |
Vật liệu xây dựng, phấn viết bảng, … |
|
Apatite |
Sản xuất phân lân (superphosphate, nung chảy,…), … |
Một số hợp chất của calcium còn có vai trò quan trọng đối với cơ thể con người như: calcium phosphate, hydroxylapatite tham gia cấu tạo xương và răng.
III. Nước cứng
1. Khái niệm, phân loại
a) Khái niệm
- Nước trong tự nhiên như nước mặt (nước sông, suối, ao, hồ,...) và nước ngầm thường hòa tan muối của nhiều ion kim loại như Ca2+, Mg2+.
- Nước chứa nhiều ion Ca2+ và Mg2+ được gọi là nước cứng. Nước chứa ít hoặc không chứa các ion Ca2+ và Mg2+ được gọi là nước mềm.
b) Phân loại
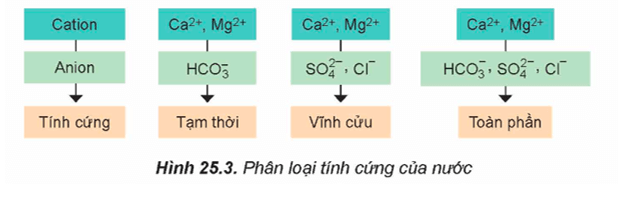
- Căn cứ vào thành phần của anion gốc acid tạo muối với ion Ca2+ và Mg2+, nước cứng được phân làm ba loại: nước có tính cứng tạm thời, nước có tính cứng vĩnh cửu và nước có tính cứng toàn phần.
- Nước tự nhiên thường có tính cứng toàn phần, tức là có cả tính cứng tạm thời và tính cứng vĩnh cửu.
2. Tác hại của nước cứng
Nước cứng ảnh hưởng nhiều đến các hoạt động trong sản xuất và đời sống.
Một số ví dụ về tác hại của nước cứng:
- Nồi hơi dễ bị đóng cặn gây tốn nhiên liệu và không an toàn.
- Đường ống dẫn nước dễ bị đóng cặn làm giảm lưu lượng nước hoặc tắc đường ống.
- Giặt bằng xà phòng sẽ tạo ra muối tí tan bám vào quần áo, xà phòng tạo tí bọt, tốn xà phòng, quần áo mau hỏng.
- Nấu ăn bằng nước cứng làm cho thực phẩm lâu chín, giảm mùi vị.
3. Làm mềm nước cứng
Nguyên tắc làm mềm nước cứng là làm giảm nồng độ các cation Ca2+ và Mg2+ trong nước cứng. Có hai phương pháp làm mềm nước cứng phổ biến: chuyển các cation Ca2+ và Mg2+ vào hợp chất không tan (phương pháp kết tủa) và thay thế những cation này bằng các cation khác (phương pháp trao đổi ion).
a) Phương pháp kết tủa
- Khi đun sôi nước cứng, muối Ca(HCO3)2 và Mg(HCO3)2 bị phân huỷ tạo ra muối không tan, làm mất tính cứng tạm thời của nước.
Ví dụ:
Mg(HCO3)2(aq) MgCO3(s) + CO2(g) + H2O(l)
- Dùng Ca(OH)2 với lượng vừa đủ để phản ứng với muối Ca(HCO3)2 và Mg(HCO3)2 tạo ra hợp chất không tan, làm mất tính cứng tạm thời của nước.
Ví dụ:
Ca(HCO3)2(aq) + Ca(OH)2(aq) 2CaCO3(s) + 2H2O(l)
- Dùng Na2CO3 hoặc Na3PO4 để làm mất tính cứng tạm thời và tính cứng vĩnh cửu của nước.
Ví dụ:
MgSO4(aq) + Na2CO3(aq) Na2SO4(aq) + MgCO3(s)
Mg(HCO3)2(aq) + Na2CO3(aq) 2NaHCO3 (aq) + MgCO3(s)
3CaCl2(aq) + 2Na3PO4(aq) 6NaCl(aq) + Ca3(PO4)2(s)
b) Phương pháp trao đổi ion
- Vật liệu có khả năng trao đổi một số ion trong thành phần cấu tạo của chúng với các ion có trong dung dịch gọi là vật liệu trao đổi ion.
- Các vật liệu trao đổi ion thường dùng trong xử lí nước cứng là các vật liệu polymer có khả năng trao đổi cation, thường gọi là nhựa cationite. Khi nước cứng chảy qua cột chứa nhựa trao đổi ion, các ion Ca2+, Mg2+ trong nước sẽ bị hấp thụ và ở lại trên cột, đồng thời các cation như Na+, H+ được giải phóng từ cột vào nước.
(199k) Xem Khóa học Hóa 12 KNTT
Xem thêm tóm tắt lý thuyết Hóa học lớp 12 Kết nối tri thức hay khác:
Lý thuyết Hóa 12 Bài 27: Đại cương về kim loại chuyển tiếp dãy thứ nhất
Lý thuyết Hóa 12 Bài 29: Một số tính chất và ứng dụng của phức chất
Xem thêm các tài liệu học tốt lớp 12 hay khác:
- Giải sgk Hóa học 12 Kết nối tri thức
- Giải Chuyên đề học tập Hóa 12 Kết nối tri thức
- Giải SBT Hóa học 12 Kết nối tri thức
- Giải lớp 12 Kết nối tri thức (các môn học)
- Giải lớp 12 Chân trời sáng tạo (các môn học)
- Giải lớp 12 Cánh diều (các môn học)
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT






 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

