100 câu trắc nghiệm Nguyên tử có lời giải (nâng cao - phần 1)
Với 100 câu trắc nghiệm Nguyên tử (nâng cao - phần 1) có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm câu trắc nghiệm Nguyên tử (nâng cao - phần 1).
100 câu trắc nghiệm Nguyên tử có lời giải (nâng cao - phần 1)
Thi online Hóa 10 KNTTThi online Hóa 10 CDThi online Hóa 10 CTST
Bài 1: Chọn câu phát biểu sai :
1. Trong một nguyên tử luôn luôn có số proton = số electron = số điện tích hạt nhân
2. Tổng số proton và số electron trong một hạt nhân gọi là số khối
3. Số khối A là khối lượng tuyệt đối của nguyên tử
4. Số proton = điện tích hạt nhân
5. Đồng vị là các nguyên tử có cùng số proton nhưng khác nhau về số neutron
A. 2,4,5
B. 2,3
C. 3,4
D. 2,3,4
Lời giải:
Chọn đáp án: B.
Giải thích:
2. Số khối là tổng số hạt proton và neutron.
3. Khối lượng tuyệt đối của nguyên tử = mp + mN
Bài 2: Cho ba nguyên tử có kí hiệu là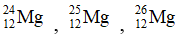
A. Số hạt electron của các nguyên tử lần lượt là: 12, 13, 14
B. Đây là 3 đồng vị.
C. Ba nguyên tử trên đều thuộc nguyên tố Mg.
D. Hạt nhân của mỗi nguyên tử đều có 12 proton.
Lời giải:
Chọn đáp án: A.
Giải thích:
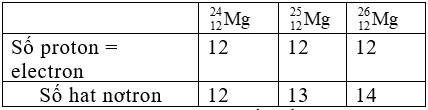
Bài 3: Sắp xếp các nguyên tử sau theo thứ tự tăng dần số neutron
A. 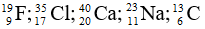
B. 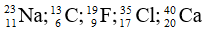
C. 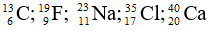
D. 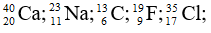
Lời giải:
Chọn đáp án: C
Giải thích: Số neutron trong các nguyên tử lần lượt là:

Bài 4: Cấu hình electron lớp ngoài cùng của nguyên tử X phân bố như sau:
Số hiệu nguyên tử và kí hiệu nguyên tử X là
A. 5, B
B. 8, O
C. 10, Ne
D. 7, N
Lời giải:
Chọn đáp án: D.
Giải thích: Cấu hình đầy đủ của X là: 1s22s22p3
Bài 5: Nguyên tử của nguyên tố R có 3 lớp e, lớp ngoài cùng có 3e. Vậy số hiệu nguyên tử của nguyên tố R là:
A. 3 B. 15
C. 14 D. 13
Lời giải:
Chọn đáp án: D
Giải thích: Cấu hình của R là 1s22s22p63s23p1
Bài 6: Phát biểu nào sau đây là đúng.
A. Những e có mức năng lượng bằng nhau được xếp vào một lớp.
B. Tất cả đều đúng.
C. Những e có mức năng lượng gần bằng nhau được xếp vào một lớp.
D. Lớp thứ n có n phân lớp( n ≤ 4)
Lời giải:
Chọn đáp án: C.
Bài 7: Một nguyên tử R có tổng số hạt mang điện và không mang điện là 34,trong đó số hạt mang điện gấp 1,833 lần số hạt không mang điện.Nguyên tố R và cấu hình electron là?
A. Na , 1s22s2 2p63s1
B. F, 1s22s2 2p5
C. Mg , 1s22s2 2p63s2
D. Ne , 1s22s2 2p6
Lời giải:
Chọn đáp án: A.
Giải thích:
Tổng số các loại hạt proton, neutron và electron của R là 34
P + n + e = 34 ⇒ 2p + n = 34 (1)
Tổng số hạt mang điện gấp 1,833 lần số hạt không mang điện
P + e = 1,833n hay 2p -1,833n = 0 (2)
Từ (1), (2) ta có p = e = 11, n =12
Cấu hình electron của R là : Na , 1s22s22p63s1
Bài 8: Tổng số hạt proton, neutron, electron của nguyên tử nguyên tố X là 10. Số khối của nguyên tử X là
A. 10 B. 6
C. 5 D. 7
Lời giải:
Chọn đáp án: D
Giải thích:
Ta có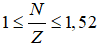
2p + n = 10 => n = 10 – 2p, thay vào (1) ta có
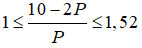
Giải ra ta có p = 3, n =4
Số khối của X = p + n = 7
Bài 9: Nguyên tử của nguyên tố Y được cấu tạo bởi 36 hạt, trong đó số hạt mang điện gấp đôi số hạt không mang điện. Cấu hình electron của Y là
A. 1s22s22p6.
B. 1s22s22p63s2.
C. 1s22s22p62d2.
D. 1s22s22p63s13p1.
Lời giải:
Chọn đáp án: B.
Giải thích:
Tổng số các loại hạt proton, neutron và electron của Y là 36
P + n + e = 36 2p + n = 36 (1)
Tổng số hạt mang điện gấp đôi lần số hạt không mang điện
P + e = 2n hay 2p -2n = 0 (2)
Từ (1), (2) ta có p = e = n = 12
Cấu hình electron của Y là : 1s22s22p63s2.
Bài 10: Trong tự nhiên Oxi có 3 đồng vị 16O(X1%) , 17O(X2%) , 18O(4%), nguyên tử khối trung bình của Oxi là 16,14. Phần trăm đồng vị 16O v à 17O lần lượt là:
A. 35% và 61%
B. 90% và 6%
C. 80% và16%
D. 25% và 71%
Lời giải:
Chọn đáp án: B
Giải thích:
Ta có :
x1 + x2 + 4 = 100
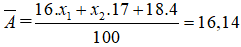
Bài 11: Một nguyên tố X có 3 đồng vị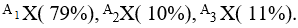
A. 24;25;26
B. 24;25;27
C. 23;24;25
D. 25;26;24
Lời giải:
Chọn đáp án: A.
Giải thích:
Ta có A1+ A2 + A3 = 75
Số khối trung bình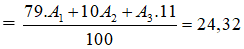
A1 + 1 = A2
Giải ra ta có A1 = 24, A2 = 25, A3 = 26
Bài 12: Nguyên tử của nguyên tố R có phân lớp ngoài cùng là 3d1. Vậy số hiệu nguyên tử của nguyên tố R là:
A. 21 B. 15
C. 25 D. 24
Lời giải:
Chọn đáp án: A.
Giải thích: Cấu hình electron đầy đủ của R là 1s22s22p63s23p63d14s2
Bài 13: Nguyên tử của nguyên tố nào sau đây khi nhận thêm 1e thì đạt cấu hình e của Ne(Z=10).
A. Cl(Z=17)
B. F(Z=9)
C. N(Z=7)
D. Na(Z=11)
Lời giải:
Chọn đáp án: B
Bài 14: Nguyên tử của nguyên tố R có tổng số hạt p,n,e bằng 18. Số hạt không mang điện bằng trung bình cộng của tổng số hạt mang điện.Vậy số electron độc thân của nguyên tử R là
A. 1 B. 2
C. 3 D. 4
Lời giải:
Chọn đáp án: B.
Giải thích:
Tổng số các loại hạt proton, neutron và electron của R là 18
P + n + e = 18 ⇒ 2p + n = 18 (1)
Số hạt không mang điện bằng trung bình cộng của tổng số hạt mang điện
N = (p+e)/2 hay n = p = e (2)
Từ (1), (2) ta có p = e = n =6
Cấu hình e của R : 1s22s22p2. Số electron độc thân = 2
Bài 15: Một ion X2+ có tổng số hạt proton, neutron, electron là 92, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 20. So hạt neutron và electron trong ion X lần lượt là
A. 36 và 27.
B. 36 và 29.
C. 29 và 36.
D. 27 và 36.
Lời giải:
Chọn đáp án: B.
Giải thích:
Tổng số các loại hạt proton, neutron và electron của X2+ là 92
P + n + e -2 = 92 ⇒ 2p + n = 94 (1)
Tổng số hạt mang điện gấp nhiều hơn số hạt không mang điện là 20
(P + e - 2) – n = 20 hay 2p – n = 22 (2)
Từ (1), (2) ta có p = e = 29, n =36
Bài 16: Nguyên tử của nguyên tố X có tống số hạt cơ bản là 49, trong đó số hạt không mang điện bằng 53,125% số hạt mang điện. Số điện tích hạt nhân của X là:
A. 18 B. 17
C. 15 D. 16
Lời giải:
Chọn đáp án: D
Giải thích:
Tổng số các loại hạt proton, neutron và electron của X là 49
P + n + e = 49 ⇒ 2p + n = 49 (1)
Tổng số hạt không mang điện bằng 53,125% số hạt mang điện
n = 53,125% (p+e) hay n = 53,125%.2p (2)
Từ (1), (2) ta có p = e = 16, n =17
Bài 17: M và X là hai nguyên tử kim loại, tổng số hạt cơ bản của cả nguyên tử M và X là 142, trong đó tổng số hạt mang điện nhiều hơn không mang điện là 42. Số hạt mang điện trong nguyên tử M nhiều hơn trong nguyên tử X là 12. Tìm M và X
A. Na, K.
B. K, Ca.
C. Mg, Fe.
D. Ca, Fe.
Lời giải:
Chọn đáp án: D
Giải thích:
Ta có: ZM + ZX = (142 : 42) : 4 = 46.
2ZM – 2ZX = 12 (tổng số hạt mang điện là 2Z)
Dễ dàng tìm được ZM = 26, ZX = 20. Vậy M là Fe, X là Ca.
Bài 18: Nguyên tử R có tống số hạt cơ bản là 52, trong đó số hạt không mang điện trong hạt nhân gấp 1,059 lần số hạt mang điện tích âm. Kết luận nào sau đây không đúng với R ?
A. Hạt mang điện nhiều hơn hạt không mang điện là 16.
B. R có số khối là 35.
C. Điện tích hạt nhân của R là 17+.
D. R có 17 neutron.
Lời giải:
Chọn đáp án: D.
Giải thích:
Tổng số các loại hạt proton, neutron và electron của R là 52
P + n + e = 52 ⇒ 2p + n = 52 (1)
Tổng số hạt không mang điện gấp 1,059 số hạt mang điện âm
n = 1,059.e hay n -1,059p = 0 (2)
Từ (1), (2) ta có p = e =17 , n =18
Số khối của R = 35.
Sử dụng dữ kiện sau trả lời cho câu hỏi số 19, 20
Nguyên tố Cu có nguyên tử khối trung bình là 63,54 có 2 đồng vị X và Y, biết tổng số khối là 128. Số ng tử đồng vị X = 0,37 số nguyên tử đồng vị Y.
Bài 19: Vậy phần trăm của từng đồng vị là
A. 73 và 27
B. 27 và 73
C. 54 và 46
D. 46 và 54
Lời giải:
Chọn đáp án: B.
Bài 20: Số khối của X và Y lần lượt là
A. 65 và 67
B. 63 và 66
C. 64 và 66
D. 65 và 63
Lời giải:
Chọn đáp án: D
Giải thích:
Gọi số khối của hai đồng vị X, Y là A1 và A2; phần trăm số nguyên tử của hai đồng vị này là x1 và x2. Theo giả thiết ta có :
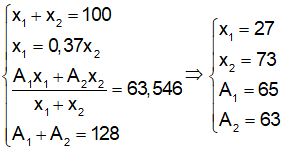
Bài 21: Cho biết: 8O và 15P. Xác định số hạt mang điện có trong P2O5 ?
A. 46 hạt
B. 92 hạt
C. 140 hạt
D. 70 hạt.
Lời giải:
Chọn đáp án: C
Giải thích: Số hạt mang điện trong P2O5 bằng 2.2.15 + 2.5.8 = 140 hạt
Bài 22: Tổng số hạt mang điện dương trong phân tử CO2 (Cho 6C và 8O)
A. 14 B. 28
C. 22 D. 44
Lời giải:
Chọn đáp án: C.
Giải thích: Số hạt mang điện dương = pC + pO.2 = 6 + 8.2 = 22 hạt
Bài 23: Nguyên tố X có 2 đồng vị X1 và X2. Đồng vị X1 có tổng số hạt là 18. Đồng vị X2 có tổng số hạt là 20. Biết rằng % các đồng vị bằng nhau và các loại hạt trong X1 cũng bằng nhau. Nguyên tử khối trung bình của X là:
A. 15 B. 14
C. 12 D. 13
Lời giải:
Chọn đáp án: D.
Giải thích:
X1 có tổng các loại hạt bằng = 18 và các hạt trong X1 bằng nhau
Ta có p + e + n = 18 mặt khác p = e =n => p = e = n =6
X2 có số hạt proton bằng số hạt proton trong X1 do cùng là đồng vị:
2p + n = 20 => n = 8, Ta có số khối của X1 = 12, X2 = 14
%X1 = % X2 = 50%.
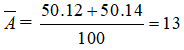
Bài 24: Cho 5,85 gam muối NaX tác dụng với dd AgNO3 dư ta thu được 14,35 gam kết tủa trắng. Nguyên tố X có hai đồng vị 35X(x1%) và 37X(x2%). Vậy giá trị của x1% và x2% lần lượt là:
A. 25% & 75%
B. 75% & 25%
C. 65% & 35%
D. 35% & 65%
Lời giải:
Chọn đáp án: B
Giải thích:
Ta có NaX + AgNO3 → NaNO3 + AgX
M tăng = 108 - 23 = 85, m tăng = 8,5
nAgX = 0,1, MAgX = 143,5 => X :35,5(Cl)
ta có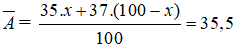
Bài 25: Nguyên tử X có điện tích hạt nhân là +2,7234.10-18C. Trong nguyên tử X số hạt mang điện nhiều hơn số hạt không mang điện là 16. Kí hiệu nguyên tử của X là
A. 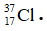
B. 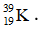
C. 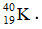
D. 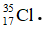
Lời giải:
Chọn đáp án: D
Giải thích:
1 hạt proton có điện tích là +1,602.10-19C.
⇒ Số hạt proton trong X = 17
Trong X số hạt mang điện nhiều hơn số hạt không mang điện là 16:
2p – n = 16 => n = 18
Số khối của X = p + n = 35
Bài 26: Tổng điện tích lớp vỏ của nguyên tử R có điện tích bằng -32.10-19C. Nguyên tố R là
A. Mg.
B. Ca.
C. K.
D. Al.
Lời giải:
Chọn đáp án: B.
Giải thích:
1 hạt electron có điện tích là -1,602.10-19C.
Số hạt electron trong X = p = 20.
Bài 27: Nguyên tố X có tổng số hạt p, n, e là 28 hạt. Kí hiệu nguyên tử của X là
A. 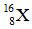
B. 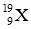
C. 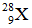
D. 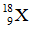
Lời giải:
Chọn đáp án: B.
Giải thích:
Ta có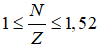
2p + n = 28 => n = 28 – 2p, thay vào (1) ta có
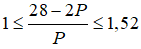
Giải ra ta có p = 9, n =10
Số khối của X = p + n = 19
Bài 28: Hợp chất vô cơ T có công thức phân tử XY2. Tổng số các hạt trong phân tử T là 66, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 22 hạt. Số khối của Y nhiều hơn X là 4. Số hạt trong Y nhiều hơn số hạt trong X là 6 hạt. Công thức phân tử của T là:
A. N2O.
B. NO2.
C. OF2.
D. CO2.
Lời giải:
Chọn đáp án: D.
Giải thích:
Gọi tổng số hạt proton, neutron và electron của nguyên tử X là : pX, nX, eX và y là pY, nY, eY.
Tổng số hạt proton, neutron và electron của nguyên tử XY2 là 66
pX + nX + ex + 2.(py + ny + ey)= 66 hay 2pX + nX + 4py +2ny = 66 (1) pX = ex và py = ey.
Số hạt mang điện nhiều hơn số hạt không mang điện là 22 nên :
pX + ex + 2py + 2ey – nX - 2ny = 22 2pX + 4py - nX - 2ny = 22 (2)
Số khối của Y nhiều hơn X là 4
pX + nX – (py + ny) = 4 (3)
Số hạt trong Y nhiều hơn số hạt trong X là 6 hạt
py + ny + ey – (pX + nX + ex) = 6 hay 2py + ny – (2pX + nX) = 6 (4)
Từ (1), (2), (3), (4) ta có : pX = 6 (C) và py = 8 (O).
Bài 29: Tổng số hạt electron trong ion NH4+, biết N (Z=7) và H (Z=1)
A. 8 B. 11
C. 10 D. 12
Lời giải:
Chọn đáp án: C
Giải thích: Số hạt electron trong ion là (nhường đi 1 e): pN + pH.4 – 1 = 10 hạt
Bài 30: Tổng số hạt cơ bản trong ion X3- là 49, trong đó tổng số hạt mang điện nhiều hơn không mang điện là 17, X là
A. S B. P
C. Si D. Cl
Lời giải:
Chọn đáp án: B.
Giải thích:
Tổng số các loại hạt proton, neutron và electron của X3- là 49
P + n + e +3 = 49 2p + n = 46 (1)
Tổng số hạt mang điện nhiều hơn hạt không mang điện là 17
P + e + 3 – n = 17 hay 2p -n = 14 (2)
Từ (1), (2) ta có p = e = 15, n =16
Cấu hình electron của R là : Na , 1s22s22p63s1
Bài 31: Nguyên tử S(Z=16) nhận thêm 2e thì cấu hình e tương ứng của nó là:
A. 1s22s22p6 3s1
B. 1s22s22p6
C. 1s22s22p6 3s3
D. 1s22s2 2p63s23p6
Lời giải:
Chọn đáp án: D.
Giải thích: Cấu hình của S 1s22s22p63s23p4
=> cấu hình của S2-(nhận thêm 2 e): 1s22s22p63s23p6
Bài 32: Nguyên tử của nguyên tố X có 3 lớp e, lớp ngoài cùng có 5e. Vậy số hiệu nguyên tử của nguyên tố X là
A. 3 B. 15
C. 14 D. 13
Lời giải:
Chọn đáp án: B
Giải thích: Cấu hình của X là 1s22s22p63s23p3
Bài 33: Nguyên tử M2+ có cấu hình electron của phân lớp ngoài cùng là 3d7. Tổng số electron của nguyên tử M là:
A. 24 B. 25
C. 27 D. 29
Lời giải:
Chọn đáp án: D.
Giải thích:
Cấu hình đầy đủ của M là:
Cấu hình của R là 1s22s22p63s23p63d104s1
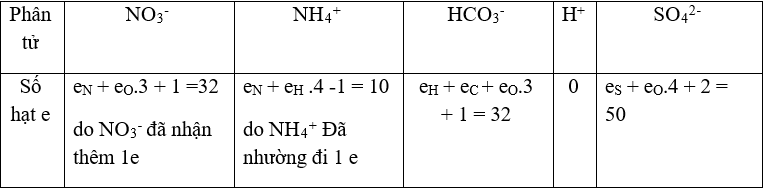
Bài 34: Số electron trong các ion sau: NO3-, NH4+ , HCO3-, H+ , SO42- theo thứ tự là
A. 32, 12, 32, 1, 50.
B. 31,11, 31, 2, 48.
C. 32, 10, 32, 2, 46.
D. 32, 10, 32, 0, 50.
Lời giải:
Chọn đáp án: D.
Giải thích: Số hạt e trong các nguyên tử N (e = 7), H (e= 1),O (e=8), S (e = 16), C(e=6).
Bài 35: Chọn câu phát biểu đúng :
1.Trong một nguyên tử luôn luôn có số proton = số neutron= số điện tích hạt nhân
2.Tổng số proton và số neutron trong một hạt nhân gọi là số khối
3.Số khối A là khối lượng tuyệt đối của nguyên tử
4.Số proton cho biết số hiệu điện tích hat nhân.
5.Đồng vị là các nguyên tử có cùng số proton nhưng khác nhau về số electron
A. 2, 4, 5
B. 2, 3
C. 3, 4
D. 1, 2, 4
Lời giải:
Chọn đáp án: D
Bài 36: Cho ba nguyên tử có kí hiệu là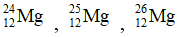
A. Số hạt electron của các nguyên tử lần lượt là: 12, 13, 14
B. Đây là 3 đồng vị.
C. Ba nguyên tử trên đều thuộc nguyên tố Mg.
D. Hạt nhân của mỗi nguyên tử đều có 12 proton.
Lời giải:
Chọn đáp án: A.
Giải thích:
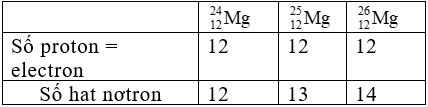
Bài 37: Sắp xếp các nguyên tử sau theo thứ tự tăng dần số neutron:
A. 1;2;3;4
B. 3;2;1;4
C. 2;3;1;4
D. 4;3;2;1
Lời giải:
Chọn đáp án: C
Bài 38: Trong tự nhiên Cu có hai đồng vị: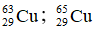
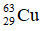
A. 73,00 %
B. 27,00%
C. 32,33%
D. 34,18 %
Lời giải:
Chọn đáp án: D.
Giải thích:
Phần trăm đồng vị 63Cu = x, thì % đồng vị 65Cu = 100 - x
Ta có
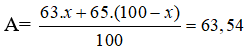
Phần trăm khối lượng của 63Cu trong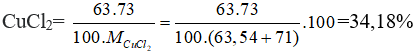
Bài 39: Phân tử XY3 có tổng số hạt proton, neutron và electron bằng 196, trong đó hạt mang điện nhiều hơn số hạt không mang điện là 60. Tổng số hạt trong Y- nhiều hơn trong X3+ là 16. Công thức của XY3 là:
A. CrCl3.
B. FeCl3.
C. AlCl3.
D. SnCl3.
Lời giải:
Chọn đáp án: C.
Giải thích:
Gọi tổng số hạt proton, neutron và electron của nguyên tử X là : pX, nX, eX và y là pY, nY, eY.
Tổng số hạt proton, neutron và electron của nguyên tử XY3 là 196
Px + nx + ex + 3.(py + ny + ey)= 196 hay 2px + nx + 6py + 3ny = 196 (1) px = ex và py = ey.
Số hạt mang điện nhiều hơn số hạt không mang điện là 60 nên :
Px + ex + 3py + 3ey – nx - 3ny = 22 2px + 6py - nx - 3ny = 60 (2)
Tổng số hạt trong Y- nhiều hơn trong X3+ là 16
2Py + ny + 1 – (2px + nx – 3) = 16 hay 2py – 2px + ny –nx = 12
Giải ra ta có px = 13 (Al), py = 17 (Cl).
Bài 40: Trong phân tử XY2 có 30 proton. Trong nguyên tử X cũng như Y có số proton bằng số neutron. X và Y lần lượt là:
A. C và O.
B. S và O.
C. Si và O.
D. C và S.
Lời giải:
Chọn đáp án: C.
Giải thích:
Gọi tổng số hạt proton, neutron và electron của nguyên tử X là : pX, nX, eX và y là pY, nY, eY.
Tổng số hạt proton của nguyên tử XY2 là 30
px + 2py = 30, py < 15 , dựa vào đáp án => Y là O (p=8), vậy px = 14 (Si)
Thi online Hóa 10 KNTTThi online Hóa 10 CDThi online Hóa 10 CTST
Xem thêm các dạng bài tập Hóa học lớp 10 có trong đề thi Tốt nghiệp THPT khác:
- 100 câu trắc nghiệm Nguyên tử có lời giải (cơ bản - phần 1)
- 100 câu trắc nghiệm Nguyên tử có lời giải (cơ bản - phần 2)
- 100 câu trắc nghiệm Nguyên tử có lời giải (cơ bản - phần 3)
- 100 câu trắc nghiệm Nguyên tử có lời giải (nâng cao - phần 2)
- 100 câu trắc nghiệm Nguyên tử có lời giải (nâng cao - phần 3)
Để học tốt lớp 10 các môn học sách mới:
- Giải bài tập Lớp 10 Kết nối tri thức
- Giải bài tập Lớp 10 Chân trời sáng tạo
- Giải bài tập Lớp 10 Cánh diều
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Lớp 10 - Kết nối tri thức
- Soạn văn 10 (hay nhất) - KNTT
- Soạn văn 10 (ngắn nhất) - KNTT
- Soạn văn 10 (siêu ngắn) - KNTT
- Giải sgk Toán 10 - KNTT
- Giải sgk Vật lí 10 - KNTT
- Giải sgk Hóa học 10 - KNTT
- Giải sgk Sinh học 10 - KNTT
- Giải sgk Địa lí 10 - KNTT
- Giải sgk Lịch sử 10 - KNTT
- Giải sgk Kinh tế và Pháp luật 10 - KNTT
- Giải sgk Tin học 10 - KNTT
- Giải sgk Công nghệ 10 - KNTT
- Giải sgk Hoạt động trải nghiệm 10 - KNTT
- Giải sgk Giáo dục quốc phòng 10 - KNTT
- Lớp 10 - Chân trời sáng tạo
- Soạn văn 10 (hay nhất) - CTST
- Soạn văn 10 (ngắn nhất) - CTST
- Soạn văn 10 (siêu ngắn) - CTST
- Giải Toán 10 - CTST
- Giải sgk Vật lí 10 - CTST
- Giải sgk Hóa học 10 - CTST
- Giải sgk Sinh học 10 - CTST
- Giải sgk Địa lí 10 - CTST
- Giải sgk Lịch sử 10 - CTST
- Giải sgk Kinh tế và Pháp luật 10 - CTST
- Giải sgk Hoạt động trải nghiệm 10 - CTST
- Lớp 10 - Cánh diều
- Soạn văn 10 (hay nhất) - Cánh diều
- Soạn văn 10 (ngắn nhất) - Cánh diều
- Soạn văn 10 (siêu ngắn) - Cánh diều
- Giải sgk Toán 10 - Cánh diều
- Giải sgk Vật lí 10 - Cánh diều
- Giải sgk Hóa học 10 - Cánh diều
- Giải sgk Sinh học 10 - Cánh diều
- Giải sgk Địa lí 10 - Cánh diều
- Giải sgk Lịch sử 10 - Cánh diều
- Giải sgk Kinh tế và Pháp luật 10 - Cánh diều
- Giải sgk Tin học 10 - Cánh diều
- Giải sgk Công nghệ 10 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 10 - Cánh diều
- Giải sgk Giáo dục quốc phòng 10 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

