Bài tập xác định thành phần nguyên tử lớp 10 (cách giải + bài tập)
Chuyên đề phương pháp giải bài tập xác định thành phần nguyên tử lớp 10 chương trình sách mới hay, chi tiết với bài tập tự luyện đa dạng giúp học sinh ôn tập, biết cách làm bài tập xác định thành phần nguyên tử.
Bài tập xác định thành phần nguyên tử lớp 10 (cách giải + bài tập)
Thi online Hóa 10 KNTTThi online Hóa 10 CDThi online Hóa 10 CTST
I. Lý thuyết và phương pháp giải
- Ba loại hạt cơ bản tạo nên nguyên tử là:
+ Hạt electron, kí hiệu là e, mang điện tích âm.
+ Hạt proton, kí hiệu là p, mang điện tích dương.
+ Hạt neutron, kí hiệu là n, không mang điện.
- Gọi số hạt proton, neutron, electron có trong nguyên tử lần lượt là P, N, E. Ta có:
+ Nguyên tử trung hòa về điện nên P = E.
+ Tổng số hạt có trong nguyên tử = P + E + N hay 2P + N.
+ Tổng số hạt có trong hạt nhân nguyên tử = P + N.
+ Tổng số hạt mang điện trong nguyên tử = P + E = 2P.
- Chú ý:
+ Số hiệu nguyên tử (Z) = số đơn vị điện tích hạt nhân = số proton = số electron.
+ Số khối (A) = số proton + số neutron = P + N = Z + N.
+ Với các nguyên tử bền, ta luôn có:
II. Ví dụ minh họa
Ví dụ 1: Hạt nhân của nguyên tử nguyên tố A có 24 hạt, trong đó số hạt không mang điện là 12. Số electron trong A là
A. 12. B. 24.
C. 13. D. 6.
Hướng dẫn giải
Đáp án đúng là: A
Xét nguyên tử nguyên tố A:
+ Hạt nhân của nguyên tử có 24 hạt ⇒ số proton + số neutron = 24.
+ Số hạt không mang điện là 12 ⇒ số neutron là 12.
Vậy nguyên tử A có số electron = số proton = 24 – 12 = 12.
Ví dụ 2: X là nguyên tố hóa học có trong thành phần của muối ăn. Nguyên tử X có tổng số các loại hạt bằng 52, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 16 hạt. Xác định thành phần các hạt cấu tạo nên nguyên tử X.
Hướng dẫn giải
Gọi P, N và E lần lượt là số proton, neutron và electron của X. Trong đó P = E.
Nguyên tử X có tổng số các loại hạt bằng 52 nên:
P + N + E = 52 hay 2P + N = 52 (1)
Trong nguyên tử X, số hạt mang điện nhiều hơn số hạt không mang điện là 16 hạt nên:
(P + E) – N = 16 hay 2P – N = 16 (2)
Từ (1) và (2) ta có hệ phương trình:
Vậy trong X có 17 proton; 17 electron và 18 neutron.
Ví dụ 3: Tổng số hạt proton, neutron và electron trong nguyên tử của nguyên tố X là 10. Số khối của nguyên tử nguyên tố X là
A. 3. B. 4.
C. 6. D. 7.
Hướng dẫn giải
Đáp án đúng là: D
Trong X: số proton = số electron = số hiệu nguyên tử (Z)
Đặt số neutron trong X là N.
Với các nguyên tử bền ta có: (1)
Theo bài ra có:
Tổng số hạt proton, neutron và electron trong nguyên tử của nguyên tố X là 10 nên:
2Z + N = 10 ⇒ N = 10 – 2Z, thay vào (1) ta có:
⇔ Z ≤ 10 – 2Z ≤ 1,52Z
⇔ 2,84 ≤ Z ≤ 3,33
Vậy Z = 3 thỏa mãn ⇒ N = 4.
Số khối của X bằng Z + N = 7.
III. Bài tập vận dụng
Câu 1: Fluorine và hợp chất của nó được sử dụng làm chất chống sâu răng, chất cách điện, chất làm lạnh, vật liệu chống dính, ... Nguyên tử fluorine chứa 9 electron và có số khối là 19. Tổng số hạt proton, electron và neutron trong nguyên tử fluorine là
A. 19
B. 28
C. 30
D. 32
Câu 2: Hợp kim chứa nguyên tố X nhẹ và bền, dùng chế tạo vỏ máy bay, tên lửa. Nguyên tố X còn được sử dụng trong xây dựng, ngành điện và đồ gia dụng. Nguyên tử của nguyên tố X có tổng số hạt (proton, electron, neutron) là 40. Trong nguyên tử X, tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 12.
Số proton và neutron trong X lần lượt là
A. 13 và 14. B. 13 và 13.
C. 14 và 13. D. 14 và 14.
Câu 3: Các hợp chất của nguyên tố Y được sử dụng như là vật liệu chịu lửa trong các lò sản xuất sắt, thép, kim loại màu, thủy tinh và xi măng. Oxide của Y và các hợp chất khác cũng được sử dụng trong nông nghiệp, công nghiệp hóa chất và xây dựng. Nguyên tử Y có tổng số các hạt là 36. Số hạt không mang điện bằng một nửa hiệu số giữa tổng số hạt với số hạt mang điện tích âm. Số khối của Y là
A. 12. B. 24.
C. 36. D. 40.
Câu 4. Tổng số hạt cơ bản của 1 nguyên tử X là 82, trong đó tổng số hạt mang điện nhiều hơn số hạt không mang điện là 22. Nguyên tử X là
A. Na (Z = 11).
B. K (Z = 19).
C. Fe (Z = 26).
D. Cu (Z = 29).
Câu 5: Tổng số hạt cơ bản trong phân tử X có công thức là M2O là 140, trong phân tử X thì tổng số hạt mang điện nhiều hơn số hạt không mang điện là 44. Vậy X là
A. Na (Z = 11).
B. K (Z = 19).
C. Fe (Z = 26).
D. Mg (Z = 12).
Câu 6: Nguyên tử N có 7 proton, nguyên tử H có 1 proton. Số lượng hạt proton và electron có trong ion NH4+ là
A. 11 proton và 10 electron.
B. 11 proton và 11 electron.
C. 10 proton và 11 electron.
D. 10 proton và 10 electron.
Câu 7: Nitrogen giúp bảo quản tinh trùng, phôi, máu và tế bào gốc. Biết nguyên tử nitrogen có tổng số hạt là 21, trong đó số hạt không mang điện chiếm 33,33%. Nitrogen có số khối là
A. 21. B. 14.
C. 7. D. 28.
Câu 8: Tổng số hạt mang điện trong hợp chất MgO là 40. Số hạt mang điện trong nguyên tử Mg nhiều hơn số hạt mang điện trong nguyên tử O là 8. Điện tích hạt nhân của Mg và O lần lượt là
A. 12+ và 8+.
B. 8 + và 12+.
C. +12 và +8.
D. +8 và +12.
Câu 9: Mỗi phân tử XY2 có tổng các hạt proton, neutron, electron bằng 178; trong đó, số hạt mang điện nhiều hơn số hạt không mang điện là 54, số hạt mang điện của X ít hơn số hạt mang điện của Y là 12. Kí hiệu hóa học của X, Y lần lượt là
A. Fe và S.
B. Fe và O.
C. Cu và S.
D. Cu và O.
Câu 10: Nguyên tử sắt (iron) có điện tích hạt nhân là +26. Trong nguyên tử, số hạt mang điện nhiều hơn số hạt không mang điện là 22. Số khối của nguyên tử sắt là
A. 26.
B. 30.
C. 56.
D. 22.
Câu 11: Tính tổng số proton, neutron và electron trong một phân tử carbon dioxide (CO2). Biết trong phân tử này, nguyên tử C có 6 proton và 6 neutron; nguyên tử O có 8 proton và 8 neutron.
A. 42 hạt.
B. 66 hạt.
C. 60 hạt.
D. 55 hạt.
Câu 12: Nguyên tử X có khối lượng là 3,173.10-23g. Trong X, số neutron nhiều hơn số proton 1 hạt. Số proton, neutron, electron trong ion X- lần lượt là
(cho mp ≈ mn ≈ 1,67.10-27kg, me ≈ 9,1.10-31kg)
A. 9, 10, 10.
B. 10, 9, 10.
C. 8, 10, 8.
D. 9, 10, 9.
Câu 13: Trong nguyên tử một nguyên tố M có tổng số các loại hạt là 58. Biết trong ion M+ thì số hạt mang điện tích dương ít hơn số hạt không mang điện là 1 hạt. Kí hiệu của M là
A. .
B.
C. .
D. .
Câu 14: Nguyên tử của một nguyên tố X có tổng số các loại bằng 115. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 25 hạt. Số khối của nguyên tử X là
A. 35.
B. 80.
C. 115.
D. 90.
Câu 15: Tổng số hạt proton, neutron và electron trong hai nguyên tử X và Y là 96 hạt, trong đó tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 32 hạt. Số hạt mang điện của nguyên tử Y nhiều hơn của nguyên tử X là 16. Số hiệu nguyên tử của X và Y lần lượt là
A. 12 và 24.
B. 13 và 25.
C. 12 và 20.
D. 11 và 20.
Thi online Hóa 10 KNTTThi online Hóa 10 CDThi online Hóa 10 CTST
Xem thêm các dạng bài tập Hóa học 10 hay, chi tiết khác:
- Tính khối lượng, kích thước nguyên tử, hạt nhân
- Xác định kí hiệu nguyên tử nguyên tố hóa học
- Bài tập về đồng vị, nguyên tử khối trung bình
- Bài tập xác định cấu hình electron của nguyên tử, ion
- Trắc nghiệm lý thuyết Bảng tuần hoàn các nguyên tố hóa học
Để học tốt lớp 10 các môn học sách mới:
- Giải bài tập Lớp 10 Kết nối tri thức
- Giải bài tập Lớp 10 Chân trời sáng tạo
- Giải bài tập Lớp 10 Cánh diều
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Lớp 10 - Kết nối tri thức
- Soạn văn 10 (hay nhất) - KNTT
- Soạn văn 10 (ngắn nhất) - KNTT
- Soạn văn 10 (siêu ngắn) - KNTT
- Giải sgk Toán 10 - KNTT
- Giải sgk Vật lí 10 - KNTT
- Giải sgk Hóa học 10 - KNTT
- Giải sgk Sinh học 10 - KNTT
- Giải sgk Địa lí 10 - KNTT
- Giải sgk Lịch sử 10 - KNTT
- Giải sgk Kinh tế và Pháp luật 10 - KNTT
- Giải sgk Tin học 10 - KNTT
- Giải sgk Công nghệ 10 - KNTT
- Giải sgk Hoạt động trải nghiệm 10 - KNTT
- Giải sgk Giáo dục quốc phòng 10 - KNTT
- Lớp 10 - Chân trời sáng tạo
- Soạn văn 10 (hay nhất) - CTST
- Soạn văn 10 (ngắn nhất) - CTST
- Soạn văn 10 (siêu ngắn) - CTST
- Giải Toán 10 - CTST
- Giải sgk Vật lí 10 - CTST
- Giải sgk Hóa học 10 - CTST
- Giải sgk Sinh học 10 - CTST
- Giải sgk Địa lí 10 - CTST
- Giải sgk Lịch sử 10 - CTST
- Giải sgk Kinh tế và Pháp luật 10 - CTST
- Giải sgk Hoạt động trải nghiệm 10 - CTST
- Lớp 10 - Cánh diều
- Soạn văn 10 (hay nhất) - Cánh diều
- Soạn văn 10 (ngắn nhất) - Cánh diều
- Soạn văn 10 (siêu ngắn) - Cánh diều
- Giải sgk Toán 10 - Cánh diều
- Giải sgk Vật lí 10 - Cánh diều
- Giải sgk Hóa học 10 - Cánh diều
- Giải sgk Sinh học 10 - Cánh diều
- Giải sgk Địa lí 10 - Cánh diều
- Giải sgk Lịch sử 10 - Cánh diều
- Giải sgk Kinh tế và Pháp luật 10 - Cánh diều
- Giải sgk Tin học 10 - Cánh diều
- Giải sgk Công nghệ 10 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 10 - Cánh diều
- Giải sgk Giáo dục quốc phòng 10 - Cánh diều

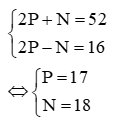



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

