Lý thuyết Hợp chất có oxi của lưu huỳnh (hay, chi tiết)
Bài viết Lý thuyết Hợp chất có oxi của lưu huỳnh hay, chi tiết giúp bạn nắm vững kiến thức trọng tâm Hợp chất có oxi của lưu huỳnh.
Lý thuyết Hợp chất có oxi của lưu huỳnh (hay, chi tiết)
Thi online Hóa 10 KNTTThi online Hóa 10 CDThi online Hóa 10 CTST
I. Sulfur dioxide
1. Cấu tạo phân tử
Ở trạng thái kích thích 4 electron độc thân ở các phân lớp 3p và 3d của nguyên tử S liên kết với 4 electron độc thân của 2 nguyên tử O tạo thành 4 liên kết cộng hóa trị có cực:
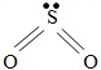
Để phù hợp với quy tắc bát tử, có thể biểu diễn như sau:
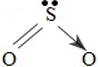
2. Tính chất vật lí
- Là khí độc, không màu, mùi hắc, nặng hơn không khí.
- Tan nhiều trong nước.
- Hóa lỏng ở -10oC.
3. Tính chất hóa học
a. Sulfur dioxide là acidic oxide
- SO2 tan trong nước tạo thành axit yếu và không bền.
SO2 + H2O ⇋ H2SO3
- SO2 tác dụng với dd bazo tạo 2 muối: muối axit HSO3-, muối trung hòa SO32-.
SO2 + NaOH → NaHSO3 (1)
SO2 + 2NaOH → Na2SO3 + H2O (2)
Nếu 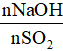
1 < 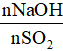
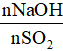
b. Sulfur dioxide là chất khử và là chất oxi hóa
* SO2 là chất khử (S+4 - 2e → S+6)
Khi gặp chất oxi hóa mạnh như O2, Cl2, Br2: khí SO2 đóng vai trò là chất khử.
2SO2 + O2 → 2SO3
SO2 + Cl2 + 2H2O → 2HCl + H2SO4
5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4 + 2H2SO4
* SO2 là chất oxi hoá (S+4 + 4e → S0) khi tác dụng chất khử mạnh:
SO2 + 2H2S → 2H2O + 3S
SO2 + Mg → MgO + S
4. Sulfur dioxide – chất gây ô nhiễm
SO2 là chất chủ yếu gây ô nhiễm môi trường, là nguyên nhân chính gây ra mưa axit.
Không khí có SO2 gây ảnh hưởng rất lớn đến sức khỏe con người: gây viêm phổi, mắt, da.
5. Ứng dụng và điều chế
a. Ứng dụng
- Sản xuất axit sunfuric.
- Tấy trắng giấy, bột giấy.
- Chống nấm mốc cho lương thực.
b. Điều chế
- Trong phòng thí nghiệm:
Đun nóng dd H2SO4 với muối Na2SO3, sau đó thu SO2 bằng cách đẩy không khí.
Na2SO3 + H2SO4 → Na2SO4 + H2O + SO2
- Trong công nghiệp:
Đốt cháy S hoặc đốt cháy quặng sunfua kim loại.
Ví dụ: đốt pirit sắt (FeS2)
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
II. Sulfur trioxide
1. Cấu tạo phân tử
Ở trạng thái kích thích, S có cấu hình electron lớp ngoài cùng là: 3s13p33d2

2. Tính chất, ứng dụng và điều chế
a. Tính chất vật lí
- Ở điều kiện thường, SO3 là chất lỏng không màu, tan vô hạn trong nước và trong axit H2SO4.
- tnc = ở 17oC, tsôi = 45oC.
b. Tính chất hóa học
SO3: sulfur trioxide, là 1 acidic oxide
* Tác dụng với H2O tạo axit sunfuric: SO3 + H2O → H2SO4
SO3 tan vô hạn trong H2SO4 tạo oleum H2SO4.nSO3
* Tác dụng với bazo, basic oxide tạo muối
SO3 + 2NaOH → Na2SO4 + H2O
SO3 + Na2O → Na2SO4
c. Ứng dụng và điều chế
- Ứng dụng
Trong thực tiễn, SO3 có ít ứng dụng nhưng nó là sản phẩm trung gian để sản xuất axit H2SO4.
- Điều chế
Oxi hóa SO2 ở nhiệt độ cao 450o – 500oC, xúc tác V2O5.
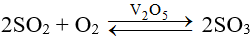
III. Axit sunfuric
1. Cấu tạo phân tử
H2SO4

2. Tính chất vật lí
Axit sunfuric (H2SO4) là chất lỏng sánh như dầu, không màu, không bay hơi, nặng gần gấp 2 lần nước (H2SO4 98% có D = 1,84 g/cm3).
H2SO4 tan vô hạn trong nước và toả nhiệt rất nhiều nhiệt.
Nếu ta rót nước vào H2SO4, nước sôi đột ngột và kéo theo những giọt axit bắn ra xung quanh gây nguy hiểm. Vì vậy, muốn pha loãng axit H2SO4 đặc, người ta phải rót từ từ axit vào nước và khuấy nhẹ bằng đũa thuỷ tinh mà không được làm ngược lại.
3. Tính chất hóa học
a. Tính chất chung của dung dịch axit sunfuric loãng
- Làm quỳ tím chuyển màu đỏ.
- Tác dụng kim loại(trước H2) giải phóng H2, tác dụng bazơ, basic oxide và nhiều muối.
Ví dụ:
Fe + H2SO4 → FeSO4 + H2
NaOH + H2SO4 → NaHSO4 + H2O
CuO + H2SO4 → CuSO4 + H2O
BaCl2 + H2SO4 → BaSO4 + 2HCl
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
b. Tính chất của axit sunfuric đặc
- Tính oxi hóa mạnh:
+ Tác dụng với kim loại: oxi hoá hầu hết các kim loại (trừ Au và Pt) tạo muối hoá trị cao và thường giải phóng SO2 (có thể H2S, S nếu kim loại khử mạnh như Mg).
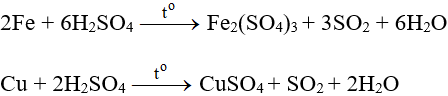
Al, Fe, Cr không tác dụng với H2SO4 đặc nguội, vì kim loại bị thụ động hóa.
+ Tác dụng với phi kim (tác dụng với các phi kim ở dạng rắn, to) tạo hợp chất của phim kim ứng với số oxh cao nhất.
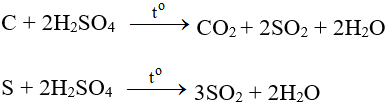
+ Tác dụng với một số chất có tính khử:
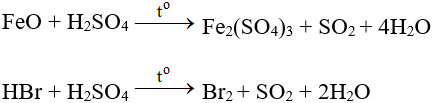
Tính háo nước: Hút nước của 1 số chất hữu cơ.
C12H22O11 + H2SO4(đ) → 12C + H2SO4.11H2O
4. Ứng dụng
- Axit sunfuric là hoá chất hàng đầu được dùng trong nhiều ngành sản xuất. Hàng năm, các nước trên thế giới sản xuất khoảng 160 triệu tấn H2SO4.
- Axit sunfuric được dùng để sản xuất phân bón, thuốc trừ sâu, chất giặt rửa tổng hợp, tơ sợi hoá học, chất dẻo, sơn màu, phẩm nhuộm, dược phẩm, chế biến dầu mỏ, ...
5. Sản xuất
Axit sunfuric được sản xuất trong công nghiệp bằng phương pháp tiếp xúc. Phương pháp này có 3 công đoạn chính:
- Sản xuất sulfur dioxide (SO2)
Phụ thuộc vào nguồn nguyên liệu có sẵn, người ta đi từ nguyên liệu ban đầu là lưu huỳnh hoặc pirit sắt FeS2, ...
Đốt cháy lưu huỳnh:
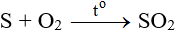
Đốt quặng pirit sắt FeS2:
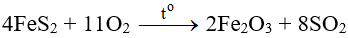
- Sản xuất sulfur trioxide (SO3)
Oxi hoá SO2 bằng khí oxi hoặc không khí dư ở nhiệt độ 450 - 500oC, xúc tác V2O5:
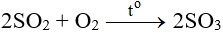
- Hấp thụ SO3 bằng H2SO4
Dùng H2SO4 98% hấp thụ SO3, được oleum H2SO4.nSO3:
H2SO4 + nSO3 → H2SO4.nSO3
Sau đó dùng lượng nước thích hợp pha loãng oleum, được H2SO4 đặc:
H2SO4.nSO3 + nH2O → (n + 1)H2SO4
6. Muối sunfat và nhận biết ion sunfat
a. Muối sunfat
Muối sunfat là muối của axir sunfuric. Có 2 loại muối sunfat:
- Muối trung hoà (muối sunfat) chứa ion sunfat SO. Phần lớn muối sunfat đều tan trừ BaSO4, SrSO4, PbSO4 không tan.
- Muối axit (muối hiđrosunfat) chứa ion hiđrosunfat HSO4.
b. Nhận biết ion sunfat
Thuốc thử nhận biết ion sunfat là dung dịch muối bari. Sản phẩm phản ứng là bari sunfat BaSO4 kết tủa trắng, không tan trong axit.
H2SO4 + BaCl2 → BaSO4 + 2HCl
Na2SO4 + Ba(OH)2 → BaSO4 + 2Na
Thi online Hóa 10 KNTTThi online Hóa 10 CDThi online Hóa 10 CTST
Xem thêm các phần Lý thuyết Hóa học lớp 10 ôn thi Tốt nghiệp THPT khác:
Lý thuyết hydrogen sulfide - sulfur dioxide - sulfur trioxide
- Lý thuyết Oxi
- Lý thuyết Ozon và hiđro peoxit
- Lý thuyết hydrogen sulfide
- Tóm tắt lý thuyết Hóa học 10 chương 6
Để học tốt lớp 10 các môn học sách mới:
- Giải bài tập Lớp 10 Kết nối tri thức
- Giải bài tập Lớp 10 Chân trời sáng tạo
- Giải bài tập Lớp 10 Cánh diều
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Lớp 10 - Kết nối tri thức
- Soạn văn 10 (hay nhất) - KNTT
- Soạn văn 10 (ngắn nhất) - KNTT
- Soạn văn 10 (siêu ngắn) - KNTT
- Giải sgk Toán 10 - KNTT
- Giải sgk Vật lí 10 - KNTT
- Giải sgk Hóa học 10 - KNTT
- Giải sgk Sinh học 10 - KNTT
- Giải sgk Địa lí 10 - KNTT
- Giải sgk Lịch sử 10 - KNTT
- Giải sgk Kinh tế và Pháp luật 10 - KNTT
- Giải sgk Tin học 10 - KNTT
- Giải sgk Công nghệ 10 - KNTT
- Giải sgk Hoạt động trải nghiệm 10 - KNTT
- Giải sgk Giáo dục quốc phòng 10 - KNTT
- Lớp 10 - Chân trời sáng tạo
- Soạn văn 10 (hay nhất) - CTST
- Soạn văn 10 (ngắn nhất) - CTST
- Soạn văn 10 (siêu ngắn) - CTST
- Giải Toán 10 - CTST
- Giải sgk Vật lí 10 - CTST
- Giải sgk Hóa học 10 - CTST
- Giải sgk Sinh học 10 - CTST
- Giải sgk Địa lí 10 - CTST
- Giải sgk Lịch sử 10 - CTST
- Giải sgk Kinh tế và Pháp luật 10 - CTST
- Giải sgk Hoạt động trải nghiệm 10 - CTST
- Lớp 10 - Cánh diều
- Soạn văn 10 (hay nhất) - Cánh diều
- Soạn văn 10 (ngắn nhất) - Cánh diều
- Soạn văn 10 (siêu ngắn) - Cánh diều
- Giải sgk Toán 10 - Cánh diều
- Giải sgk Vật lí 10 - Cánh diều
- Giải sgk Hóa học 10 - Cánh diều
- Giải sgk Sinh học 10 - Cánh diều
- Giải sgk Địa lí 10 - Cánh diều
- Giải sgk Lịch sử 10 - Cánh diều
- Giải sgk Kinh tế và Pháp luật 10 - Cánh diều
- Giải sgk Tin học 10 - Cánh diều
- Giải sgk Công nghệ 10 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 10 - Cánh diều
- Giải sgk Giáo dục quốc phòng 10 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

