Lý thuyết Phân loại phản ứng trong hóa học vô cơ (hay, chi tiết)
Bài viết Phân loại phản ứng trong hóa học vô cơ hay, chi tiết giúp bạn nắm vững kiến thức trọng tâm Phân loại phản ứng trong hóa học vô cơ.
Lý thuyết Phân loại phản ứng trong hóa học vô cơ (hay, chi tiết)
Thi online Hóa 10 KNTTThi online Hóa 10 CDThi online Hóa 10 CTST
Bài giảng: Bài 18: Phân loại phản ứng trong hóa học vô cơ - Cô Phạm Thu Huyền (Giáo viên VietJack)
I. Phản ứng hóa học là gì ?
1. Phản ứng hóa học là gì?
- Phản ứng hóa học là quá trình biến đổi từ chất này sang chất khác.
- Chất bị biến đổi trong phản ứng là chất phản ứng hay chất tham gia.
- Chất mới sinh ra là sản phẩm.
- PT chữ của phản ứng hóa hoc:
Tên các chất tham gia → Tên các sản phẩm.
- Cách đọc phương trình chữ của PƯHH:
• Dấu “+” sau phản ứng đọc là “và”
• Dấu “ → ” đọc là “tạo thành” hay “tạo ra” hoặc “phân hủy ra”
• Dấu “+” ở trước phản ứng đọc là “tác dụng với” hay “phản ứng với”
VD1: Hãy đọc các phương trình chữ sau:
a. Sắt + lưu huỳnh → Sắt (II) sunfua.
“Sắt tác dụng với lưu huỳnh tạo thành sắt hai sunfua”
b. Đường → nước + than
“Đường phân hủy thành nước và than”
c. Than + oxi → khí carbonic
“Than phản ứng với oxi tạo thành khí carbonic”
d. Kẽm + axit → Kẽm clorua + khí hiđro
“Kẽm tác dụng với axit tạo ra kẽm clorua và khí hiđro”
VD2. Hãy viết phương trình chữ khi cây nến cháy (biết nến là parafin)?
Hướng dẫn: Parafin + oxi → cacbonic + nước
- Trong quá trình phản ứng lượng chất tham gia giảm dần còn lượng chất sản phẩm tăng dần.
2. Diễn biến của phản ứng hóa hoc
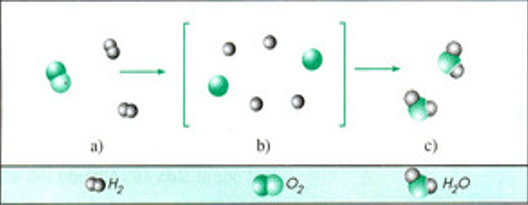
Từ sơ đồ phản ứng hóa học giữa hiđro và oxi tạo thành nước ta thấy : Trong phản ứng hóa học chỉ có liên kết giữa các nguyên tử thay đổi làm cho phân tử này biến đổi thành phân tử khác.
Lưu ý:
- Nếu có đơn chất kim loại tham gia phản ứng thì sau phản ứng nguyên tử kim loại phải liên kết với nguyên tử của nguyên tố khác.
- Nếu đơn chất là kim loại thì nguyên tử kim loại sẽ tham gia phản ứng.
3. Điều kiện để có phản ứng hóa học xảy ra
- Chất tham gia phản ứng tiếp xúc nhau.
- Có thể cần có nhiệt độ.
- Có thể cần xúc tác thích hợp.
4. Dấu hiệu có thể nhận biết phản ứng hóa học xảy ra.
- Có thể thay đổi màu sắc, trạng thái, mùi.
- Tỏa nhiệt, thu nhiệt hoặc phát sáng.
- Tạo ra kết tủa, bay hơi, hoặc đổi màu.
II. Các loại phản ứng hóa học
a/ Phản ứng hoá hợp
4P + O2 → P2O5
Là phản ứng hóa học, trong đó 2 hay nhiều chất hóa hợp với nhau tạo thành một chất mới.
Tгопg phản ứng hoá hợp, số oxi hoá của các nguyên tố có thể thay đổi hoặc không thay đổi.
b/ Phản ứng phân huỷ
2Fe(OH) 3 → Fe2 O3 + 3H2 O
Là phản ứng hóa học, trong đó một chất bị phân hủy thành 2 hay nhiều chất mới
Trong phản ứng phân huý, số oxi hoá của các nguyên tố có thể thay đổi hoặc không thav đổi.
c/ Phản ứng thế
Là phản ứng hóa học, trong đó nguyên tử của nguyên tố này ở dạng đơn chất thay thế nguyên tử của nguyên tố khác trong hợp chất
Fe + HCl → FeCl2 + H2
Trong hoá học vô cơ, phản ứng thế bao giờ cũng có sự thay đổi số oxi hoá của các nguyên tố.
d/ Phản ứng trao đổi
Là phản ứng hóa học, trong đó các hợp chất trao đổi nguyên tử hay nhóm nguyên tử với nhau
Trong phản ứng trao đổi, số oxi hoá của các nguyên tố không thay đổi.
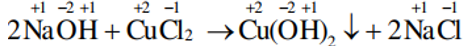
Các phản ứng trao đổi, một số phản ứng hoá hợp và một số phản ứng phân huỷ thuộc loại phản ứng hoá học này.
Thi online Hóa 10 KNTTThi online Hóa 10 CDThi online Hóa 10 CTST
Xem thêm các phần Lý thuyết Hóa học lớp 10 ôn thi Tốt nghiệp THPT khác:
- Tóm tắt lý thuyết Hóa học 10 chương 4
- 50 câu trắc nghiệm Phản ứng oxi hóa, khử có lời giải (cơ bản - phần 1)
- 50 câu trắc nghiệm Phản ứng oxi hóa, khử có lời giải (cơ bản - phần 2)
- 50 câu trắc nghiệm Phản ứng oxi hóa, khử có lời giải (nâng cao - phần 1)
- 50 câu trắc nghiệm Phản ứng oxi hóa, khử có lời giải (nâng cao - phần 2)
Để học tốt lớp 10 các môn học sách mới:
- Giải bài tập Lớp 10 Kết nối tri thức
- Giải bài tập Lớp 10 Chân trời sáng tạo
- Giải bài tập Lớp 10 Cánh diều
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Lớp 10 - Kết nối tri thức
- Soạn văn 10 (hay nhất) - KNTT
- Soạn văn 10 (ngắn nhất) - KNTT
- Soạn văn 10 (siêu ngắn) - KNTT
- Giải sgk Toán 10 - KNTT
- Giải sgk Vật lí 10 - KNTT
- Giải sgk Hóa học 10 - KNTT
- Giải sgk Sinh học 10 - KNTT
- Giải sgk Địa lí 10 - KNTT
- Giải sgk Lịch sử 10 - KNTT
- Giải sgk Kinh tế và Pháp luật 10 - KNTT
- Giải sgk Tin học 10 - KNTT
- Giải sgk Công nghệ 10 - KNTT
- Giải sgk Hoạt động trải nghiệm 10 - KNTT
- Giải sgk Giáo dục quốc phòng 10 - KNTT
- Lớp 10 - Chân trời sáng tạo
- Soạn văn 10 (hay nhất) - CTST
- Soạn văn 10 (ngắn nhất) - CTST
- Soạn văn 10 (siêu ngắn) - CTST
- Giải Toán 10 - CTST
- Giải sgk Vật lí 10 - CTST
- Giải sgk Hóa học 10 - CTST
- Giải sgk Sinh học 10 - CTST
- Giải sgk Địa lí 10 - CTST
- Giải sgk Lịch sử 10 - CTST
- Giải sgk Kinh tế và Pháp luật 10 - CTST
- Giải sgk Hoạt động trải nghiệm 10 - CTST
- Lớp 10 - Cánh diều
- Soạn văn 10 (hay nhất) - Cánh diều
- Soạn văn 10 (ngắn nhất) - Cánh diều
- Soạn văn 10 (siêu ngắn) - Cánh diều
- Giải sgk Toán 10 - Cánh diều
- Giải sgk Vật lí 10 - Cánh diều
- Giải sgk Hóa học 10 - Cánh diều
- Giải sgk Sinh học 10 - Cánh diều
- Giải sgk Địa lí 10 - Cánh diều
- Giải sgk Lịch sử 10 - Cánh diều
- Giải sgk Kinh tế và Pháp luật 10 - Cánh diều
- Giải sgk Tin học 10 - Cánh diều
- Giải sgk Công nghệ 10 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 10 - Cánh diều
- Giải sgk Giáo dục quốc phòng 10 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

