3 dạng bài tập về hydrocarbon thơm trong đề thi Đại học (có lời giải)
Với 3 dạng bài tập về hydrocarbon thơm trong đề thi Đại học có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập về hydrocarbon thơm trong đề thi Đại học.
3 dạng bài tập về hydrocarbon thơm trong đề thi Đại học (có lời giải)
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Hydrocarbon thơm: CnH2n-6 ( n ≥ 6)
Dạng 1: Phản ứng thế (Clo hóa; brom hóa, nitro hóa)
Phương pháp:
+ Sử dụng quy tắc thế trên vòng benzene.
+ Với điều kiện phản ứng: askt, t°C phản ứng thế xảy ra trên mạch nhánh no của vòng benzene
+ Trong bài toán liên quan đến phản ứng nitro hóa thì sản phẩm thu được thường là hỗn hợp các chất, vì vậy ta nên sử dụng phương pháp trung bình để tính toán.
Ví dụ minh họa
Ví dụ 1 : Hỗn hợp gồm 1 mol C6H6 và 1,5 mol Cl2. Trong điều kiện có xúc tác bột Fe, to, hiệu suất 100%. Sau phản ứng thu được chất gì ? bao nhiêu mol ?
A. 1 mol C6H5Cl ; 1 mol HCl ; 1 mol C6H4Cl2.
B. 1,5 mol C6H5Cl ; 1,5 mol HCl ; 0,5 mol C6H4Cl2.
C. 1 mol C6H5Cl ; 1,5 mol HCl ; 0,5 mol C6H4Cl2.
D. 0,5 mol C6H5Cl ; 1,5 mol HCl ; 0,5 mol C6H4Cl2.
Hướng dẫn giải:
Tỉ lệ mol
⇒ phản ứng tạo ra hỗn hợp hai sản phẩm là C6H5Cl và C6H4Cl2.
Phương trình phản ứng :
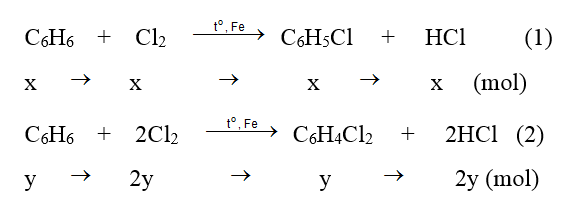
Theo giả thiết ta có :
Vậy sau phản ứng thu được 0,5 mol C6H5Cl ; 1,5 mol HCl ; 0,5 mol C6H4Cl2.
⇒ Đáp án D
Ví dụ 2 : TNT (2,4,6- trinitrotoluene) được điều chế bằng phản ứng của toluene với hỗn hợp gồm HNO3 đặc và H2SO4 đặc, trong điều kiện đun nóng. Biết hiệu suất của toàn bộ quá trình tổng hợp là 80%. Lượng TNT (2,4,6- trinitrotoluene) tạo thành từ 230 gam toluene là
A. 550,0 gam. B. 687,5 gam.
C. 454,0 gam. D. 567,5 gam.
Hướng dẫn giải:
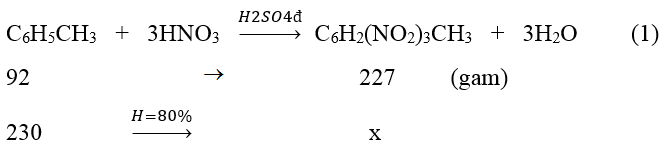
Theo phương trình và giả thiết ta thấy khối lượng TNT (2,4,6-trinitrotoluene) tạo thành từ 230 gam toluene với hiệu suất 80% là :
x = 230.227/92.80% =454gam.
⇒ Đáp án C
Ví dụ 3 : Nitro hoá bezen thu được hỗn hợp 2 chất hữu cơ X và Y, trong đó Y nhiều hơn X một nhóm –NO2. Đốt cháy hoàn toàn 12,75 gam hỗn hợp X, Y thu được CO2, H2O và 1,232 lít N2 (đktc). Công thức phân tử và số mol X trong hỗn hợp là :
A. C6H5NO2 và 0,9. B. C6H5NO2 và 0,09.
C. C6H4(NO2)2 và 0,1. D. C6H5NO2 và 0,19.
Hướng dẫn giải:
Đặt công thức phân tử trung bình của hai hợp chất nitro là
Sơ đồ phản ứng cháy :
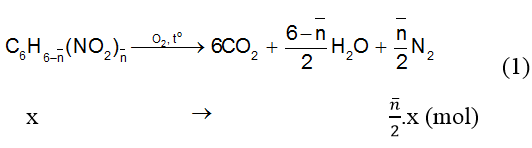
Theo (1) và theo giả thiết ta có :
Theo giả thiết hỗn hợp hai chất nitro hơn kém nhau một nhóm –NO¬2. Căn cứ vào giá trị số nhóm –NO2 trung bình là 1,1 ta suy ra hai hợp chất X và Ycó công thức là C6H5NO2 và C6H4(NO2)2.
Áp dụng sơ đồ đường chéo :
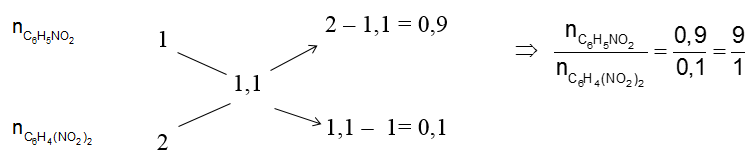
Vậy số mol của nC6H5NO2 = 9/10 .0,1 = 0,09
⇒ Đáp án B
Dạng 2: Phản ứng oxi hóa
+ Phản ứng oxi hóa không hoàn toàn: benzene không bị oxi hóa bởi dung dịch KMnO4, các đồng đẳng của benzene bị oxi hóa bởi KMnO4 khi đun nóng.
+ Phản ứng oxi hóa hoàn toàn : Trong phản ứng oxi hóa hoàn toàn benzene và các đồng đẳng của benzene ta có
Ví dụ minh họa
Ví dụ 1 : Đốt cháy hết 9,18 gam 2 đồng đẳng của benzene A, B thu được 8,1 gam H2O và V lít CO2 (đktc). Giá trị của V là :
A. 15,654. B. 15,465. C. 15,546. D. 15,456
Hướng dẫn giải:
Đặt công thức phân tử trung bình của A và B là :
Theo giả thiết ta có :
nH2O = 8,1/18 = 0,45 mol
=> mH = 0,45.2 = 0,9 gam
=> mC = 9,18 - 0,9 = 8,28 gam
=> nCO2 = nC = 8,28/12 = 0,69 mol
VCO2 = 0,69.22,4=15,456 lít.
⇒ Đáp án D.
Ví dụ 2 : Để oxi hoá hết 10,6 gam o-xylen (1,2-dimethylbenzen) cần bao nhiêu lít dung dịch KMnO4 0,5M trong môi trường H2SO4 loãng. Giả sử dùng dư 20% so với lượng phản ứng.
A. 0,48 lít. B. 0,24 lít. C. 0,12 lít. D. 0,576 lít.
Hướng dẫn giải:
Phương trình phản ứng :
5H3C-C6H4-CH3+12KMnO4+18H2SO4 → 5HOOC-C6H4-COOH + 6K2SO4+12MnSO4 +28H2O
nKMnO4 = 12/5.n o-xylen = 0,24 mol
⇒ nKMnO4 dùng = 0,24 + 0,24.20% = 0,288mol
Vdd KMnO4 = 0,288 : 0,5 = 0,576 (mol)
⇒ Đáp án D
Có thể dùng phương pháp bảo toàn e:
Mn+7 + 5e → Mn+2
2C-3 → 2C+3 + 12e
5nKMnO4 = 12no-xylen
Ví dụ 3 : Đốt cháy hết 9,18 gam 2 đồng đẳng kế tiếp thuộc dãy của benzene A, B thu được H2O và 30,36 gam CO2. Công thức phân tử của A và B lần lượt là :
A. C6H6 ; C7H8. B. C8H10 ; C9H12. C. C7H8 ; C9H12. D. C9H12 ; C10H14
Hướng dẫn giải:
Đặt công thức phân tử trung bình của A và B là :
Phương trình phản ứng :
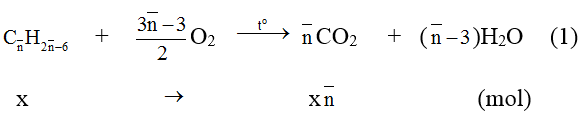
Theo (1) và giả thiết ta có :
Vậy Công thức phân tử của A và B lần lượt là C8H10 và C9H12.
⇒ Đáp án B.
Ví dụ 4 : Đốt cháy hoàn toàn 2,12 gam aren X sau đó cho toàn bộ sản phẩm cháy qua bình đựng dung dịch nước vôi trong dư thấy khối lượng bình tăng thêm 8,84 gam và trong bình có m gam kết tủa. Xác định m?
A. 16,2 gam B. 16,0 gam C. 18,0 gam D. 19,8 gam
Hướng dẫn giải:
CTPT aren: CnH2n-6 (x mol)
CnH2n-6 → nCO2 + (n-3)H2O
x xn x(n-3) (mol)
mbình tăng = mCO2 + mH2O = 8,84g
⇒ 44xn + 18x(n-3) =8,84g ⇒ 62xn – 54x = 8,84g (1)
maren = 2,12 ⇒ (14n – 6)x = 2,12g ⇒ 14nx – 6x = 2,12g(2)
Từ (1)(2) ⇒ xn = 0,16 mol; x = 0,02 mol
⇒ nCO2 = nCaCO3 = xn = 0,16 mol
m = 0,16.100 = 16g ⇒ Đáp án B
Dạng 3: Trùng hợp styrene
Phương pháp:
nC6H5 – CH=CH2 to, Fe→ (- CH(C6H5) – CH2-)n
+ Thường xác định styrene còn dư
+ Đồng trùng hợp với buta – 1,3 – diene ( tỉ lệ theo hệ số trùng hợp)
Ví dụ minh họa
Ví dụ 1 : Đề hiđro hoá etylbenzen ta được styrene; trùng hợp styrene ta được polistiren với hiệu suất chung 80%. Khối lượng etylbenzen cần dùng để sản xuất 10,4 tấn polisitren là :
A.13,52 tấn. B. 10,6 tấn. C. 13,25 tấn. D. 8,48 tấn.
Hướng dẫn giải:
Sơ đồ phản ứng :
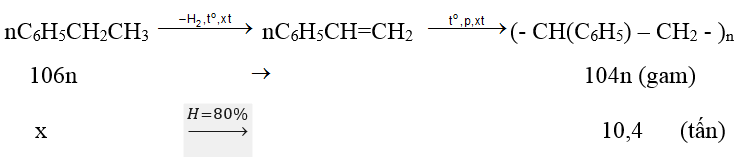 10,4 (tấn)
10,4 (tấn)
Vậy khối lượng etylbenzen cần dùng để sản xuất 10,4 tấn polisitren với hiệu suất 80% là :
x = 10,4.106n/104n:80% = 13,25tấn.
⇒ Đáp án C.
Ví dụ 2 : Đem trùng hợp 5,2 gam styrene hỗn hợp sau phản ứng cho tác dụng với 100ml dd Br2 0,15 M sau đó tiếp tục cho thêm KI dư vào thì được 0,635 gam iot . Khối lượng polymer tạo thành là:
A. 5,2g B. 3,9 C.3,64g D. 4,16g
Hướng dẫn giải:
nI2= 0,0025 (mol)
nBr2= 0,015 (mol)
do Br2 dư tác dụng với
2KI + Br2→2KBr + I2
0,0025 0,0025
nBr2 pư với styrene= 0,015 – 0,0025= 0,0125 (mol)
(C6H5) - CH=CH2 + Br2 → (C6H5) – CH(Br ) - CH2-Br
0,0125 ← 0,0125 (mol)
mstyrene dư tác dụng với Br2 = 0,0125 . 104= 1,3 (g)
m styrene trùng hợp = 5,2- 1,3 = 3,9 (g) = mpolymer
Ví dụ 3 : Tiến hành trùng hợp 20,8 gam styrene. Hỗn hợp thu được sau phản ứng tác dụng vừa đủ với 500ml dung dịch Br2 0,2M. Phần trăm styrene đã tham gia phản ứng trùng hợp là
A. 25%. B. 50%. C. 60%. D. 75%.
Hướng dẫn giải:
nBr2 = nstyrene dư =0,2.0,5 = 0,1 mol
mstyrene dư = 0,1.104 = 10,4g ⇒ mstyrene trùng hợp = 20,8 – 10,4 = 10,4g
%mstyrene trùng hợp = (10,4 )/20,8 .100% = 50%
⇒ Đáp án B
Ví dụ 4 : Tiến hành phản ứng đồng trùng hợp giữa styrene và buta – 1,3 – diene (butadiene), thu được polymer X. Cứ 2,834 gam X phản ứng vừa hết với 1,731 gam Br2. Tỉ lệ số mắt xích (butadiene : styrene) trong loại polymer trên là
A. 1 : 1. B. 1 : 2. C. 2:3 D. 1:3
Hướng dẫn giải:
Gọi tỉ lệ mắt xích butadiene : styrene = x : y
xCH2 = CH – CH = CH2 + yC6H5 – CH = CH2 to→ [(-CH2 – CH = CH – CH2)x – (CH(C6H5) – CH2-)y]
Ta có: nX : nBr2 = 1 : x
⇒ mX : mBr2 = (54x + 104y) : 160x
⇒ 2,834/1,731 = (54x+104y)/160x
⇒ x : y ≈ 2 : 1
⇒Đáp án B
Ví dụ 5 : PS là loại nhựa chế tạo hộp xốp đựng thức ăn. Hãy tính hệ số polymer hóa của loại nhựa này khi biết khối lượng của phân tử bằng 104 000.
A. 500 B. 1000 C. 800 D. 1040
Hướng dẫn giải:
PS: (- CH2 – CH(C6H5) - )n
Ta có: 104n = 104000 ⇒ n = 1000
⇒ Đáp án B
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Xem thêm các dạng bài tập Hóa học lớp 11 có trong đề thi Tốt nghiệp THPT khác:
- Dạng 1: Cách viết đồng phân, gọi tên benzene và đồng đẳng
- Dạng 2: Nhận biết, điều chế benzene và đồng đẳng
- Dạng 3: Dạng bài tập tính chất hóa học của benzene và đồng đẳng
- Dạng 4: Phản ứng thế của benzene
- Dạng 5: Phản ứng trùng hợp của styrene
- Dạng 6: Phản ứng oxi hóa benzene và đồng đẳng
- Dạng 7: Nguồn hydrocarbon thiên nhiên
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 11 Global Success
- Giải sgk Tiếng Anh 11 Smart World
- Giải sgk Tiếng Anh 11 Friends Global
- Lớp 11 - Kết nối tri thức
- Soạn văn 11 (hay nhất) - KNTT
- Soạn văn 11 (ngắn nhất) - KNTT
- Giải sgk Toán 11 - KNTT
- Giải sgk Vật Lí 11 - KNTT
- Giải sgk Hóa học 11 - KNTT
- Giải sgk Sinh học 11 - KNTT
- Giải sgk Lịch Sử 11 - KNTT
- Giải sgk Địa Lí 11 - KNTT
- Giải sgk Giáo dục KTPL 11 - KNTT
- Giải sgk Tin học 11 - KNTT
- Giải sgk Công nghệ 11 - KNTT
- Giải sgk Hoạt động trải nghiệm 11 - KNTT
- Giải sgk Giáo dục quốc phòng 11 - KNTT
- Giải sgk Âm nhạc 11 - KNTT
- Lớp 11 - Chân trời sáng tạo
- Soạn văn 11 (hay nhất) - CTST
- Soạn văn 11 (ngắn nhất) - CTST
- Giải sgk Toán 11 - CTST
- Giải sgk Vật Lí 11 - CTST
- Giải sgk Hóa học 11 - CTST
- Giải sgk Sinh học 11 - CTST
- Giải sgk Lịch Sử 11 - CTST
- Giải sgk Địa Lí 11 - CTST
- Giải sgk Giáo dục KTPL 11 - CTST
- Giải sgk Hoạt động trải nghiệm 11 - CTST
- Giải sgk Âm nhạc 11 - CTST
- Lớp 11 - Cánh diều
- Soạn văn 11 Cánh diều (hay nhất)
- Soạn văn 11 Cánh diều (ngắn nhất)
- Giải sgk Toán 11 - Cánh diều
- Giải sgk Vật Lí 11 - Cánh diều
- Giải sgk Hóa học 11 - Cánh diều
- Giải sgk Sinh học 11 - Cánh diều
- Giải sgk Lịch Sử 11 - Cánh diều
- Giải sgk Địa Lí 11 - Cánh diều
- Giải sgk Giáo dục KTPL 11 - Cánh diều
- Giải sgk Tin học 11 - Cánh diều
- Giải sgk Công nghệ 11 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 11 - Cánh diều
- Giải sgk Giáo dục quốc phòng 11 - Cánh diều
- Giải sgk Âm nhạc 11 - Cánh diều

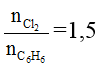
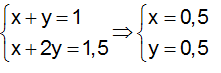
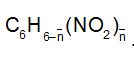
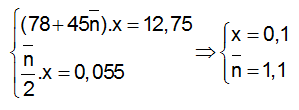
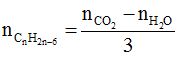
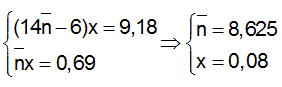



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

