Cách giải bài tập Phản ứng cộng của alkene, alkadien, alkyne (hay, chi tiết)
Bài viết Cách giải bài tập Phản ứng cộng của alkene, alkadien, alkyne với phương pháp giải chi tiết giúp học sinh ôn tập, biết cách làm bài tập Phản ứng cộng của alkene, alkadien, alkyne.
Cách giải bài tập Phản ứng cộng của alkene, alkadien, alkyne (hay, chi tiết)
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Bài giảng: Bài toán phản ứng cộng của alkene, alkyne - Cô Nguyễn Thị Nhàn (Giáo viên VietJack)
A. Phương pháp giải & Ví dụ minh họa
a/ alkene
Lý thuyết và Phương pháp giải
*Cộng Br2: CnH2n + Br2 → CnH2nBr2
- alkene : Br2 = 1 : 1 ( tỉ lệ về số mol hoặc thể tích )
- Khối lượng của bình tăng lên là khối lượng của hidrocabon không no bị hấp thụ.
- Phản ứng cộng HX của alkene tuân theo quy tắc macopnhicop.
*Cộng H2: CnH2n + H2 → CnH2n + 2
- Tỉ lệ phản ứng luôn là 1:1
- Khối lượng trước và sau phản ứng luôn bằng nhau
- Số mol sau phản ứng luôn giảm ( vì mất H2 ) → nH2 pư = nđ - ns
Ví dụ minh họa
Bài 1: Dẫn 3,36 lít hỗn hợp X gồm 2 alkene là đồng đẳng kế tiếp vào bình nước brom dư, thấy khối lượng bình tăng thêm 7,7 gam. Tìm CTPT của 2 alkene ?
Lời giải:
Số mol hỗn hợp X là: nX = 3,36/22,4 = 0,15 mol
Phương trình phản ứng:
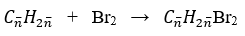
Khối lượng bình brom tăng là khối lượng của 2 alkene: mX = 7,7 gam
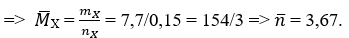
Vậy CTPT của 2 alkene kế tiếp là: C3H6 và C4H8
Bài 2: Dẫn từ từ 6,72 lit (đktc) hỗn hợp X gồm etilen và propilen và dung dịch brom, dung dịch brom bị nhạt màu, và không có khí thoát ra. Khối lượng dung dịch sau phản ứng tắng 9,8 gam. Thành phần phần trăm theo thể tích của etilen trong X là
Lời giải:
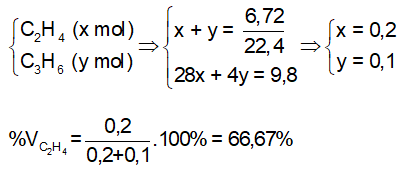
Bài 3: Cho 4,48 lit hỗn hợp X gồm etan, propane và propene qua dung dịch brom dư, thấy khối lượng bình brom tăng 4,2 gam. Lượng khí còn lại thoát ra khỏi dung dịch đem đốt cháy hoàn toàn thu được 6,48 gam nước. Tính % thể tích các chất có trong hỗn hợp.
Lời giải:
Số mol hỗn hợp X là : nX = 4,48/22,4 = 0,2 mol
Khối lượng bình brom tăng là khối lượng của propen: mpropen = 4,2 gam ⇒ npropen = 4,2/ 42 = 0,1 mol
Phương trình phản ứng: C3H6 + Br2 → C3H6Br2
Khí thoát ra gồm: C2H6 và C3H8.
Phương trình phản ứng đốt cháy C2H6 và C3H8
C2H6 + 7/2 O2 −tº→ 2CO2 + 3H2O
C3H8 + 5O2 −tº→ 3CO2 + 4H2O
nH2O = 6,48/18=0,36 mol
Gọi số mol của etan và propane lần lượt là x và y mol
Ta có x + y = 0,2 – 0,1 = 0,1 (1); 3x + 4 y = 0,36 (2)
Từ (1), (2) ⇒ x = 0,04 và y = 0,06.
Phần trăm thể tích mỗi khí trong hỗn hợp ban đầu là:
%Vetan = 0,04/0,2.100% = 20%; %Vpropan = 0,06/0,2.100% = 30%; %Vpropen = 0,1/0,2.100% = 50%
Bài 4: Hỗn hợp khí X gồm H2 và một alkene có khả năng cộng HBr cho sản phẩm hữu cơ duy nhất. Tỉ khối của X so với H2 bằng 9,1. Đun nóng X có xúc tác Ni, sau khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp khí Y không làm mất màu nước brom; tỉ khối của Y so với H2 bằng 13. Tìm công thức cấu tạo của alkene.
Lời giải:
Gọi số mol hổn hợp X là 1mol
Ta có Mtb X = 9,1. 2 = 18,2 ⇒ mX = 18,2. 1 = 18,2 g = mY
Mà Mtb Y = 13. 2 = 26 ⇒ nY = 18,2/26= 0,7 mol
⇒ nH2 pư = 1 – 0,7 = 0,3 mol = nalkene ⇒ nH2 bđ = 0,7 mol
Malkene = (18,2 - 0,7.2)/0,3 = 14n ⇒ n = 4 ⇒ CTPT của alkene là C4H8
Bài 5: Hỗn hợp khí X gồm H2 và C2H4 có tỉ khối so với He là 3,75. Dẫn X qua Ni nung nóng, thu được hỗn hợp khí Y có tỉ khối so với He là 5. Tính hiệu suất của phản ứng hiđro hoá?
Lời giải:
Ta có : Mtb X = 4. 3,75 = 15
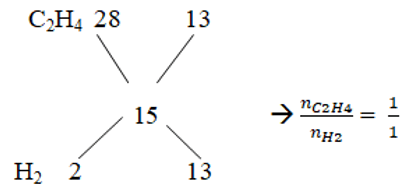
Vậy hiệu suất tính theo alkene hoặc H2 cũng được
Giả sử: nX = 1mol ⇒ mX = 15. 1 = 15 g = mY
Mà Mtb Y = 5. 4 = 20 ⇒ nY = 15/20 = 0,75 mol ⇒ nH2 pư= 1 – 0,75 = 0,25 mol
⇒ H = 0,25/0,5.100% = 50 %
b/ Akadien và Akin
Lý thuyết và Phương pháp giải
Giả sử X là hỗn hợp ban đầu gồm CnH2n-2 và H2; Y là hỗn hợp các chất sau p/ư
+ Các phản ứng xảy ra:
CnH2n-2 + H2 → CnH2n.
CnH2n-2 + 2H2 → CnH2n+2.
+ Hỗn hợp Y có thể có: CnH2n, CnH2n+2, CnH2n-2 và H2 dư
+ Quan hệ về khối lượng, ta có: mA = mB
+ Quan hệ về số mol, ta có: nA– nB= nH2 phản ứng
+ Đốt cháy B cũng là đốt cháy A.
Ví dụ minh họa
Bài 1: Cho m gam Buta -1,3- diene tác dụng vừa hết với (m - 17,5) gam H2 thu được a gam sản phẩm cộng
a. Tính giá trị của m ?
b. Giá trị của a là bao nhiêu ?
Lời giải:
CH2=CH-CH=CH2 + 2H2 → CH3-CH2-CH2CH3
a. Số mol Buta -1,3- diene: n1 = m/54 mol
Số mol H2 phản ứng: nH2 = (m-17,5)/2 mol
Theo phương trình phản ứng: 2n1 = nH2 ⇔ 2m/54 = (m-17,5)/2 ⇒ m = 18,9 gam
b. Giá trị của a là:
a = m + m – 17,5 = 20,3 gam
Bài 2: Một hỗn hợp X gồm 0,12 mol C2H2 và 0,18 mol H2. Cho X đi qua Ni nung nóng, sau một thời gian thu được hỗn hợp khí Y. Cho Y vào bình đựng brom dư, thấy bình brom tăng m gam và thoát ra khí Z. Đốt cháy hết Z và cho toàn bộ sản phẩm cháy vào bình đựng dung dịch Ca(OH)2 dư thấy có 5 gam kết tủa xuất hiện và thấy khối lượng dung dịch giảm 1,36 gam. Tính giá trị của m ?
Lời giải:
Khối lượng hỗn hợp X: mX = 0,12.26 + 0,18.2 = 3,48 g
Cho X đi qua Ni nung nóng:
Phương trình phản ứng: C2H2 + H2 → C2H4; C2H2 + 2H2 → C2H6
Hỗn hợp Y gồm: C2H2, C2H4, C2H6 và H2
Cho Y qua bình đựng Br2 dư có C2H2, C2H4 bị giữ lại. Hỗn hợp Z gồm: C2H6 và H2
Phương trình phản ứng: C2H4 + Br2 → C2H4Br2; C2H2 + 2Br2 → C2H2Br4
Đốt cháy Z thu được CO2 và H2O:
nCO2 = nCaCO3 = 0,05 mol.
mdd giảm = m↓ - (mH2O + mCO2) ⇒ mH2O = 5 - 1,36 – 0,05.44 = 1,44 g
Số mol H2O: nH2O = 1,44/18 = 0,08 mol ⇒ mZ = 0,08.2 + 0,05.12 = 0,76 g
Khối lượng bình brom tăng: m = mX - mZ = 3,48 – 0,76 = 2,72 g
Bài 3: Hỗn hợp X gồm 0,15 mol CH4; 0,09 mol C2H2 và 0,2 mol H2. Nung nóng X với xúc tác Ni thu được hỗn hợp Y. Cho Y qua dung dịch brom dư thu được hỗn hợp khí Z (có tỉ khối so với He là 4). Biết bình brom tăng 0,82 gam. Tính % thể tích của C2H6 trong hỗn hợp Z.
Lời giải:
Nung nóng X với Ni thu được hỗn hợp Y gồm: C2H2, C2H4, C2H6, CH4, H2
Cho Y qua bình brom: C2H2, C2H4 bị giữ lại. Hỗn hợp khí Z: C2H6, CH4, H2
Phương trình phản ứng: C2H4 + Br2 → C2H4Br2; C2H2 + 2Br2 → C2H2Br4
Khối lượng của hỗn hợp X: mX = 0,15.16 + 0,09.26 + 0,2.2 = 5,14 g
Khối lượng của hỗn hợp Z : mZ = 5,14 – 0,82 = 4,32 g ⇒ nZ = 4,32/16 = 0,27 mol
nH2+C2H6 = 0,27 – 0,15 = 0,12 mol
Gọi số mol của H2 và C2H6 lần lượt là: x và y ta có: x + y = 0,12 mol
2x + 30 y + 16.0,15 = 4,32 ⇒ x + 15 y = 0,96 ⇒ x = 0,06 và y = 0,06
% thể tích của C2H6 trong hỗn hợp Z: %VC2H6 = 0,06.100%/0,27 = 22,22%
B. Bài tập trắc nghiệm
Bài 1: Dẫn 0,2 mol một olefin A qua dung dịch brom dư, khối lượng bình sau phản ứng tăng 5,6 gam.Vậy công thức phân tử của A là:
A. C2H4 B. C3H6 C. C4H8 D. C5H10
Lời giải:
Đáp án: A
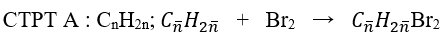
MX = 5,6/0,2 = 28 ⇒ n = 2
Bài 2: Cho V lít một alkene A ở đkc qua bình đựng nước brom dư, có 8 g Br2 đã phản ứng đồng thời khối lượng bình tăng 2,8g. Mặt khác khi cho A phản ứng với HBr chỉ thu được 1 sản phẩm . Giá trị của V và tên của A là:
A. 2,24 lít; propen B. 2,24 lít; etilen
C. 1,12 lít; but-1-en D. 1,12 lít; but-2-en
Lời giải:
Đáp án: D
CTPT A : CnH2n ; nA = nBr2 = 8/160 = 0,05 mol; MA = 2,8/0,05 = 56 ⇒ n = 4;
A phản ứng Br2 cho 1sản phẩm ⇒ A có cấu tạo đối xứng.
Bài 3: Một hỗn hợp X có thể tích 11,2 lít (đktc), X gồm 2 alkene đồng đẳng kế tiếp nhau. Khi cho X qua nước Br2 dư thấy khối lượng bình Br2 tăng 15,4g. Xác định CTPT và số mol mỗi alkene trong hỗn hợp X.
A. 0,2 mol C2H4 và 0,3 mol C3H6 B. 0,2 mol C3H6 và 0,2 mol C4H8
C. 0,4 mol C2H4 và 0,1 mol C3H6 D. 0,3 mol C2H4 và 0,2 mol C3H6
Lời giải:
Đáp án: C
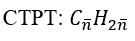
nX = 11,2/ 22,4 = 0,5 mol; mX = 15,4 gam
Mtb X = mX/nX = 15,4/0,5 = 30,8 ⇒ ntb = 2,2. 2
⇒ alkene là: C2H4 và C3H6; nC2H4 : nC3H6 = 4:1
⇒ nC2H4 = 0,4 mol và nC3H6 = 0,1 mol
Bài 4: Cho 10g hỗn hợp khí X gồm etilen và etan qua dung dịch Br2 25% có 160g dd Br2 phản ứng. % khối lượng của etilen trong hỗn hợp là:
A. 70% B. 30% C. 35,5% D. 64,5%
Lời giải:
Đáp án: A
nC2H4 = nBr2 = 25.160/100.160 = 0,25 mol ⇒ %mC2H4 = 0,25.28/10.100% = 70%
Bài 5: Khi cho hỗn hợp A gồm alkene và H2 đi qua xúc tác Ni nung nóng thu được hỗn hợp B. Điều khẳng định nào sau đây là đúng?
A. nA < nB B. nA – nB = nH2 pư C. MA = MB D. mA > mB
Lời giải:
Đáp án: B
Bài 6: Hỗn hợp khí X gồm 0,3 mol H2 và 0,1 mol propen. Nung X một thời gian với xúc tác Ni thu được hỗn hợp khí Y có tỉ khối so với H2 là 16. Tính số mol H2 phản ứng?
A. 0,15 mol B. 0,2 mol C. 0,25 mol D. 0,3 mol
Lời giải:
Đáp án: C
mX = 0,3.2 + 0,1.42 = 4,8 g ⇒ nY = 4,8/32 = 0,15 mol; nH2 pư = 0,4 – 0,15 = 0,25 mol
Bài 7: Hỗn hợp X gồm H2, C2H4 và C3H6 có tỉ khối so với H2 là 9,25. Cho 22,4 lít X (đktc) vào bình kín có sẵn một ít bột Ni. Đun nóng bình một thời gian, thu được hỗn hợp khí Y có tỉ khối so với H2 bằng 10. Tổng số mol H2 đã phản ứng là
A. 0,070 mol B. 0,015 mol
C. 0,075 mol D. 0,050 mol
Lời giải:
Đáp án: C
mX = 18,5.1 = 18,5 g; nY = 18,5/20 = 0,925 mol ⇒ nH2 pư = 1 – 0,925 = 0,075 mol
Bài 8: Hỗn hợp khí X gồm hiđro và một alkene. Nung nóng 24,64 lít hỗn hợp X (đktc), có Ni làm xúc tác. Sau phản ứng thu được 25,3 gam hỗn hợp khí Y. Tỷ khối của X so với H2 là:
A. 10,5 gam B. 11,5 gam C. 12 gam D. 12,5 gam
Lời giải:
Đáp án: B
nX = 26,64/22,4 = 1,1 mol; MX.nX = mX = mY ⇒ MX = 25,3/1,1 = 23; dX/H2 = 23/2 = 11,5
Bài 9: Hỗn hợp khí A chứa eilen và H2. Tỉ khối của A đối với hiđro là 7,5. Dẫn A đi qua chất xuc tác Ni nung nóng thu được hh khí B có tỉ khối đối với hiđro là 9,0. Hiệu suất phản ứng cộng hiđro của etilen là:
A. 33,3% B. 66,7% C. 25% D. 50%
Lời giải:
Đáp án: A
Mtb A = 2. 7,5 = 15
Giả sử nA = 1mol ⇒ mB = mA = 15. 1 = 15 g ; nC2H4 : nH2 = 1:1
Mà Mtb B = 9. 2 = 18 ⇒ nB = 0,83 mol ⇒ nH2 pư = 1 – 0,83 = 0,167 mol
⇒ H = 0,176/0,5 .100% = 33,3%
Bài 10: Đun nóng 20,16 lít hỗn hợp khí X gồm C2H4 và H2 dùng Ni xúc tác thì thu được 13,44 lít hỗn hợp khí Y. Cho Y lội thật chậm qua bình đựng dung dịch Br2 dư thì thấy khối lượng bình tăng 2,8 gam. Hiệu suất phản ứng hidro hóa alkene:
A. 40% B. 60% C. 65% D. 75%
Lời giải:
Đáp án: D
nX = 20,16/22,4 = 0,9 mol; nY = 13,44/22,4 = 0,6 mol; nH2 pư = 0,9 – 0,6 = 0,3 mol; nalkene dư = 2,8/28 = 0,1 mol; nalkene bđ = 0,1 + 0,3 = 0,4 mol ⇒ nH2 bđ = 0,5 mol ⇒ H = 0,3/0,4.100%=75%
Bài 11: Cho H2 và 1 olefin có thể tích bằng nhau qua Niken đun nóng ta được hỗn hợp A. Biết tỉ khối hơi của A đối với H2 là 23,2. Hiệu suất phản ứng hiđro hoá là 75%. Công thức phân tử olefin là
A. C2H4. B. C3H6. C. C4H8. D. C5H10.
Lời giải:
Đáp án: C
Giả sử nalkene = nH2 = 1 mol; nA = 2- 0,75 = 1,25 mol; Mđ = 23,2.2.1,25/2 = 14,5; 14.n + 2 = 2.14,5 ⇒ n = 4
Bài 12: 2,24 lít hỗn hợp X gồm buta–1,3–diene và penta–1–3-diene (đktc) có thể tác dụng hết tối đa bao nhiêu lít dung dịch brom 0,10 M ?
A. 2l B. 3l C.2,5l D.4l
Lời giải:
Đáp án: A
nBr2 = 2nX = 0,2 mol ⇒ VBr2 = 0,2/0,1 = 2 lít
Bài 13: Chất nào sau đây không phải là sản phẩm cộng giữa dung dịch brom và isoprene (theo tỉ lệ mol 1:1) ?
A. CH2BrC(CH3)BrCH=CH2. B. CH2BrC(CH3)=CHCH2Br.
C. CH2BrCH=CHCH2CH2Br. D. CH2=C(CH3)CHBrCH2Br.
Lời giải:
Đáp án: C
Bài 14: alkadien A + brom (dd) CH3C(CH3)BrCH=CHCH2Br. Vậy A là
A. 2-methylpenta-1,3-diene. B. 2-methylpenta-2,4-diene.
C. 4-methylpenta-1,3-diene. D. 2-methylButa -1,3- diene.
Lời giải:
Đáp án: C
Bài 15: Cho but-1-yne phản ứng cộng với H2 (theo tỉ lệ mol 1:1 và xúc tác Pd/PbCO3) thu được sản phẩm hữu cơ có tên là:
A. Butan B. But-2-en C. But-1-en D. A và C đều đúng.
Lời giải:
Đáp án: C
Bài 16: Cho các chất hữu cơ :
CH2=CH–CH2–CH3 (M)
CH≡C–CH2–CH3 (N)
CH2=C=CH–CH3 (P)
CH2=CH–CH=CH2 (Q)
CH2=C(CH3)–CH3 (R)
Những chất cho cùng 1 sản phẩm cộng hiđro là:
A. M, N, P, Q B. M, N, R C. M, N, R D. Q, R
Lời giải:
Đáp án: A
Bài 17: Cho m gam propin tác dụng với H2 dư (Ni, tº) thu được (m + 8) gam sản phẩm hữu cơ Y. Giá trị của m là:
A. 80 gam. B. 40 gam C. 160 gam D. 120 gam
Lời giải:
Đáp án: A
Bài 18: Cho 3,12 gam alkyne X phản ứng với 0,1 mol H2 (xúc tác Pd/PbCO3, tº), thu được hỗn hợp Y chỉ có hai hydrocarbon. Công thức phân tử của X là
A. C2H2. B. C5H8. C. C4H6. D. C3H4.
Lời giải:
Đáp án: A
nalkyne > 0,1 mol; MX < 31,2 ⇒ X là C2H2
Bài 19: Hỗn hợp X gồm C2H2 và H2 có cùng số mol. Lấy một lượng hỗn hợp X cho qua chất xúc tác nung nóng, thu được hỗn hợp Y gồm C2H4, C2H6, C2H2 và H2. Sục Y vào dung dịch brom (dư) thì khối lượng bình brom tăng 10,8 gam và thoát ra 4,48 lít hỗn hợp khí (đktc) có tỉ khối so với H2 là 8. Thể tích O2(đktc) cần để đốt cháy hoàn toàn hỗn hợp Y là:
A. 33,6 lít. B. 22,4 lít. C. 44,8 lít. D. 26,88 lít.
Lời giải:
Đáp án: A
mX = 10,8 + 16.0,2 = 14 g
mX = mC2H2 + mH2 = 26x + 2x = 28x = 14 ⇒ x = 0,5 mol;
nO2 = 0,5nH2 + 2,5nC2H2 = 0,5 + 2,5.0,5 = 1,5 mol ⇒ V = 33,6 lít
Bài 20: Đun nóng hỗn hợp khí gồm 0,06 mol C2H2 và 0,04 mol H2 với xúc tác Ni, sau một thời gian thu được hỗn hợp khí Y. Dẫn toàn bộ hỗn hợp Y lội từ từ qua bình đựng dung dịch brom (dư) thì còn lại 0,448 lít hỗn hợp khí Z (ở đktc) có tỉ khối so với O2 là 0,5. Khối lượng bình dung dịch brom tăng là:
A. 1,04 gam. B. 1,64 gam. C. 1,20 gam. D. 1,32 gam
Lời giải:
Đáp án: D
mY = 0,06.26 + 0,04.2 = 1,64 g; mZ = 0,02.16 = 0,32 g; m↑ = mY – mZ = 1,64 – 0,32 = 1,32
C. Bài tập tự luyện
Câu 1: Hỗn hợp khí X chứa H2 và một hydrocarbon A mạch hở. Tỉ khối của X đối với H2 là 4,6. Đun nóng nhẹ X có mặt xúc tác Ni thì nó biến thành hỗn hợp Y không làm mất màu nước bromine và có tỉ khối đối với H2 là 11,5. Công thức phân tử của hydrocarbon là
A. C2H2.
B. C3H4.
C. C3H6.
D. C2H4.
Câu 2: Cho 4,48 lít hỗn hợp khí X gồm CH4, C2H2, C2H4, C3H6, C3H8 và V lít khí H2 qua xúc tác Ni nung nóng đến phản ứng hoàn toàn. Sau phản ứng ta thu được 5,20 lít hỗn hợp khí Y. Các thể tích khí đo ở cùng điều kiện. Thể tích khí H2 trong Y là
A. 0,72 lít.
B. 4,48 lít.
C. 9,68 lít.
D. 5,20 lít.
Câu 3: Đun nóng hỗn hợp khí X gồm 0,06 mol C2H2, 0,05 mol C3H6 và 0,07 mol H2 với xúc tác Ni, sau một thời gian thu được hỗn hợp khí Y gồm C2H6, C2H4, C3H8, C2H2 dư, C3H6 dư và H2 dư. Đốt cháy hoàn toàn hỗn hợp Y rồi cho sản phẩm hấp thụ hết vào dung dịch nước vôi trong dư. Khối lượng bình dung dịch nặng thêm là
A. 5,04 gam.
B. 11,88 gam.
C. 16,92 gam.
D. 6,84 gam.
Câu 4: Hỗn hợp X gồm một alkene M và H2 có khối lượng phân tử trung bình 10,67 đi qua Ni nung nóng thu được hỗn hợp Y có tỉ khối so với H2 bằng 8. Biết M phản ứng hết. CTPT của M là
A. C3H6.
B. C5H10.
C. C4H8.
D. C2H4.
Câu 5: Hỗn hợp khí X chứa H2 và một alkene. Tỉ khối của X đối với H2 là 9. Đun nóng nhẹ X có mặt xúc tác Ni thì nó biến thành hỗn hợp Y không làm mất màu nước bromine và có tỉ khối đối với H2 là 15. Công thức phân tử của alkene là
A. C2H4.
B. C3H6.
C. C4H8.
D. C4H6.
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Xem thêm các dạng bài tập Hóa học lớp 11 có trong đề thi Tốt nghiệp THPT khác:
- Dạng 1: Bài tập tính chất hóa học của alkene, alkadien, alkyne
- Dạng 2: Dạng bài tập Đồng phân, danh pháp của alkene, alkadien, alkyne
- Dạng 4: Phản ứng đốt cháy của alkene, alkadien, alkyne
- Dạng 5: Phản ứng oxi hóa alkene, alkadien, alkyne
- Dạng 6: Phản ứng của alkyne với AgNO3 (Phản ứng thế hidro của Ank-1-yne)
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 11 Global Success
- Giải sgk Tiếng Anh 11 Smart World
- Giải sgk Tiếng Anh 11 Friends Global
- Lớp 11 - Kết nối tri thức
- Soạn văn 11 (hay nhất) - KNTT
- Soạn văn 11 (ngắn nhất) - KNTT
- Giải sgk Toán 11 - KNTT
- Giải sgk Vật Lí 11 - KNTT
- Giải sgk Hóa học 11 - KNTT
- Giải sgk Sinh học 11 - KNTT
- Giải sgk Lịch Sử 11 - KNTT
- Giải sgk Địa Lí 11 - KNTT
- Giải sgk Giáo dục KTPL 11 - KNTT
- Giải sgk Tin học 11 - KNTT
- Giải sgk Công nghệ 11 - KNTT
- Giải sgk Hoạt động trải nghiệm 11 - KNTT
- Giải sgk Giáo dục quốc phòng 11 - KNTT
- Giải sgk Âm nhạc 11 - KNTT
- Lớp 11 - Chân trời sáng tạo
- Soạn văn 11 (hay nhất) - CTST
- Soạn văn 11 (ngắn nhất) - CTST
- Giải sgk Toán 11 - CTST
- Giải sgk Vật Lí 11 - CTST
- Giải sgk Hóa học 11 - CTST
- Giải sgk Sinh học 11 - CTST
- Giải sgk Lịch Sử 11 - CTST
- Giải sgk Địa Lí 11 - CTST
- Giải sgk Giáo dục KTPL 11 - CTST
- Giải sgk Hoạt động trải nghiệm 11 - CTST
- Giải sgk Âm nhạc 11 - CTST
- Lớp 11 - Cánh diều
- Soạn văn 11 Cánh diều (hay nhất)
- Soạn văn 11 Cánh diều (ngắn nhất)
- Giải sgk Toán 11 - Cánh diều
- Giải sgk Vật Lí 11 - Cánh diều
- Giải sgk Hóa học 11 - Cánh diều
- Giải sgk Sinh học 11 - Cánh diều
- Giải sgk Lịch Sử 11 - Cánh diều
- Giải sgk Địa Lí 11 - Cánh diều
- Giải sgk Giáo dục KTPL 11 - Cánh diều
- Giải sgk Tin học 11 - Cánh diều
- Giải sgk Công nghệ 11 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 11 - Cánh diều
- Giải sgk Giáo dục quốc phòng 11 - Cánh diều
- Giải sgk Âm nhạc 11 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

