Cách giải bài tập Phản ứng đốt cháy của alkene, alkadien, alkyne (hay, chi tiết)
Bài viết Cách giải bài tập Phản ứng đốt cháy của alkene, alkadien, alkyne với phương pháp giải chi tiết giúp học sinh ôn tập, biết cách làm bài tập Phản ứng đốt cháy của alkene, alkadien, alkyne.
Cách giải bài tập Phản ứng đốt cháy của alkene, alkadien, alkyne (hay, chi tiết)
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Bài giảng: Bài toán phản ứng cộng của alkene, alkyne - Cô Nguyễn Thị Nhàn (Giáo viên VietJack)
A. Phương pháp giải & Ví dụ minh họa
a/ alkene
Lý thuyết và Phương pháp giải
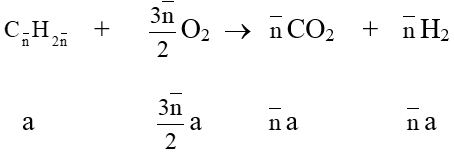
• Khi đốt cháy một nhiều hydrocarbon thuộc cùng dãy đồng đẳng tính được:
nCO = nH2O hoặc nO = 1,5nCO = 1,5nH2O
→ Các hydrocarbon đó là alkene hay cycloalkane.
• Đốt cháy hỗn hợp alkane + alkene (cycloalkane) thì
nCO < nH2O hoặc nO2 > 1,5nCO2 và nalkane = nH2O - nCO = 2(nO2- 1,5nCO2)
Ví dụ minh họa
Bài 1: Đem đốt cháy hoàn toàn 0,1 mol hỗn hợp X gồm 2 alkene là đồng đẳng kế tiếp nhau thu được CO2 và nước có khối lượng hơn kém nhau 6,76 gam.
a. Tìm công thức phân tử của 2 alkene đó?
b. Tính phần trăm khối lượng mỗi alkene trong hỗn hợp X.
Lời giải:
Phương trình đốt cháy:
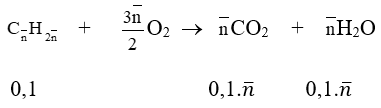
a. Ta có: 44. 0,1.ntb - 18. 0,1.ntb = 6,76 → ntb = 2,6 mol
Vậy công thức phân tử của 2 alkene đó là: C2H4 và C3H6
b. Áp dụng sơ đồ đường chéo
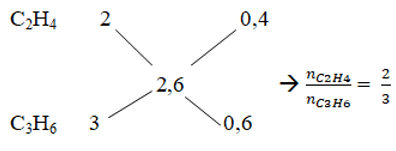
Số mol của C2H4 và C3H6 là: nC2H4 = 0,1.2/5 = 0,4 mol; nC3H6 = 0,1.3/5 = 0,6 mol
Phần trăm khối lượng của mỗi alkene là:
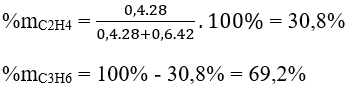
Bài 2: Đốt cháy hoàn toàn 2,24 lít đkc 1 hydrocarbon X mạch hở, sau đó dẫn sản phẩm cháy lần lượt qua dung dịch H2SO4 và dung dịch Ca(OH)2 dư. Sau thí nghiệm thấy khối lượng bình đựng dung dịch axit tăng 5,4g, bình đựng dung dịch Ca(OH)2 có 30g kết tủa. Tìm CTPT của X.
Lời giải:
Số mol X là: nX = 2,24/22,4 = 0,1 mol
Khối lượng bình đựng dung dịch axit tăng là khối lượng của H2O:
mH2O = 5,4 gam ⇒ nH2O = 5,4/18 = 0,3 mol
Số mol CO2 là: nCO2 = nCaCO3 = 30/100 = 0,3 mol
Nhận thấy: nH2O = nCO2 ⇒ hydrocarbon X là alkene
Phương trình đốt cháy:
CnH2n + 3n/2 O2 → nCO2 + nH2O
0,1 0,3
Ta có: 0,1.n = 0,3 ⇒ n = 3. Vậy CTPT của X là C3H6
b/ Akadien và Akin
Lý thuyết và Phương pháp giải
Phản ứng đốt cháy: CnH2n-2 + (3n - 1)/2 O2 → nCO2 + (n - 1)H2O
nCO2 > nH2O và nCO2 - nH2O = nalkyne.
Ví dụ minh họa
Bài 1: Hỗn hợp A gồm một alkene và một alkadiene có thể tích là 6,72 lít (đktc) được chia thành 2 phần bằng nhau:
- Phần 1: đốt cháy hoàn toàn hỗn hợp thu được 8,96 lít CO2 và 6,3 gam nước.
- Phần 2: dẫn qua dung dịch brom dư bình tăng m gam.
a. Tính thành phần phần trăm thể tích mỗi khí trong A?
b. Khối lượng m là bao nhiêu?
c. Tìm CTPT của alkene và alkadien?
Lời giải:
Số mol của hỗn hợp A là: nA = 6,72/22,4 = 0,3 mol
Số mol A trong một phần là: n = 0,15 mol
Gọi CTPT của alkene và alkadiene lần lượt là: CnH2n và CmH2m-2 (n > 1; m > 2)
Phương trình đốt cháy:
CnH2n + 3n/2 O2 → nCO2 + nH2O
CmH2m-2 + (3m-1)/2 O2 → mCO2 + (m-1) H2O
Số mol CO2 và mol H2O lần lượt là: nCO2 = 8,96/22,4 = 0,4 mol; nH2O = 6,3/18 = 0,35 mol
Số mol của alkadiene là: nankaddien = 0,4 – 0,35 = 0,05 mol
Số mol của alkene là: nalkene = 0,15 – 0,05 = 0,1 mol
a. Phần trăm thể tích mỗi khí trong A là:
%Valkene = (0,1.100%)/0,15 = 66,67 % ; %Vankaddien = 100% - 66,67% = 33,33%
b. Dẫn A qua dung dịch Brom dư thì khối lượng bình brom tăng là khối lượng của A
mA = m↑ = mC + mH = 0,4.12 + 0,35.2 = 5,5 gam
c. Theo phương trình đốt cháy ta có: 0,05m + 0,1n = 0,4 ⇒ n = 2 và m = 4
Vậy CTPT của alkene và alkadiene là: C2H4 và C4H6
Bài 2: Đốt cháy hoàn toàn hydrocarbon X, dẫn toàn bộ sản phẩm lần lượt đi qua bình 1 đựng H2SO4 dư, bình 2 đựng 400ml dd Ca(OH)2 0,5M, không có khí đi ra khỏi bình 2. Kết thúc phản ứng thấy khối lượng bình 1 tăng lên 3,6 gam, bình 2 có 10 gam kết tủa trắng. Xác định CTPT của X ?
Lời giải:
Số mol Ca(OH)2 là: nCa(OH)2 = 0,5.0,4 = 0,2 mol;
Khối lượng bình 1 tăng là khối lượng của H2O: mH2O = 3,6/18 = 0,2 mol
Số mol CaCO3: nCaCO3 = 10/100 = 0,1 mol
TH1: Khí CO2 đi vào bình 2 chỉ sinh ra CaCO3:
nCO2 = nCaCO3 = 0,1 mol
nH2O > nCO2 ⇒ hydrocarbon X là alkane.
Số mol alkane là: nalkane = 0,2 – 0,1 = 0,1 mol.
Phương trình đốt cháy:
CnH2n+ 2 + (3n+1)/2 O2 → nCO2 + (n+1)H2O
0,1 0,1 mol
Ta có : 0,1n = 0,1 ⇒ n =1. Vậy CTPT của X là CH4
TH2: Khí CO2 đi vào bình 2 tạo ra 2 muối là CaCO3 và Ca(HCO3)2
nCa(HCO3)2 = 0,2 – 0,1 = 0,1 mol
Bảo toàn nguyên tố C ta có: nCO2 = 0,1.2 + 0,1 = 0,3 mol
nCO2 > nH2O ⇒ hydrocarbon là alkyne
Phương trình đốt cháy: CnH2n-2 + (3n - 1)/2 O2 → nCO2 + (n - 1)H2O
Số mol alkyne là: nalkyne = 0,3 – 0,2 = 0,1 mol
Theo phương trình ta có: 0,1n = 0,3 ⇒ n = 3 . Vậy CTPT của alkyne là: C3H4
Bài 3: Đốt cháy hoàn toàn 14,6 gam hh A (gồm 2 alkyne X và Y là đồng đẳng liên tiếp, MX < MY) bằng oxi vừa đủ, hấp thụ toàn bộ sản phẩm cháy vào dd Ca(OH)2 dư, thấy dd thu được có khối lượng giảm đi 49 gam.
a. Xác định CTPT của X?
b. Tính % số mol của X, Y trong A?
Lời giải:
a. Gọi CTPT của 2 alkyne là:
Phương trình đốt cháy:
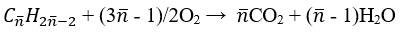
Khối lượng dung dịch giảm 49 gam ta có: m↓ = mCaCO3 – (mH2O + mCO2)
⇒ 49 = 100.nCO2 – (18.nH2O + 44.nCO2) = 56.nCO2 – 18. nH2O (1)
Mặt khác: mA = mC + mH ⇒ 14,6 = 12.nCO2 + 2.nH2O (2)
Từ (1), (2) ta có : nCO2 = 1,1 và nH2O = 0,7 mol
Số mol 2 alkyne là : nA = 1,1 – 0,7 = 0,4 mol
Theo phương trình phản ứng: 0,4. ntb = 1,1 ⇒ ntb = 2,75
Vậy CTPT của 2 alkyne là: C2H2 và C3H4
b. Áp dụng sơ đồ đường chéo ta có:
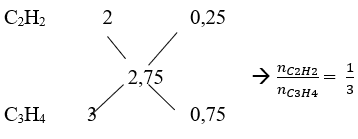
Số mol của C2H2 và C3H4 là: nC2H2 = 0,4.1/4 = 0,1 mol; nC3H4 = 0,4.3/4 = 0,3 mol
Phần trăm khối lượng của mỗi alkene là:
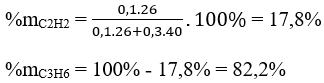
B. Bài tập trắc nghiệm
Bài 1: Đốt cháy hoàn toàn hỗn hợp 2 olefin thu được (m + 4)g H2O và (m + 30)g CO2. Giá trị của m là :
A. 14 g B. 21 g C. 28g D. 35 g.
Lời giải:
Đáp án: A
CnH2n + 3n/2 O2 → nCO2 + nH2O
nH2O = nCO2 ⇒ mH2O/18 = mCO2/44 ⇒ m = 14 g
Bài 2: Đốt cháy hoàn toàn a gam hỗn hợp eten, propen, but-2-en cần dùng vừa đủ b lít oxi (ở đktc) thu được 2,4 mol CO2. Giá trị của b là:
A. 92,4 lít. B. 94,2 lít. C. 80,64 lít. D. 24,9 lít.
Lời giải:
Đáp án: C
CnH2n + 3n/2 O2 → nCO2 + nH2O
nO2 =3/2 nO2 = 3/2 . 2,4 = 3,6 mol ⇒ VO2 = 3,6.22,4 = 80,64 lít
Bài 3: Chia hỗn hợp 2 alkene thành 2 phần bằng nhau. Đốt cháy hoàn toàn phần một trong không khí thu được 6,3 gam H2O. Phần hai cộng H2 được hỗn hợp A. Nếu đốt cháy hoàn toàn phần hai thì thể tích CO2 (đktc) tạo ra là:
A. 3,36 lít B. 7,84 lít C. 6,72 lít D. 8,96 lít
Lời giải:
Đáp án: B
CnH2n + 3n/2 O2 → nCO2 + nH2O
CnH2n + H2 → CnH2n + 2
nCO2 = nH2O = 6,3/18 = 0,35 mol; VCO2 = 0,35 .22,4 = 7,84 lít
Bài 4: Hỗn hợp X gồm C3H8 và C3H6 có tỉ khối so với hiđro là 21,8. Đốt cháy hết 5,6 lít X (đktc) thì thu được bao nhiêu gam CO2 và bao nhiêu gam H2O?
A. 33g và 17,1g. B. 22g và 9,9g.
C. 13,2g và 7,2g. D. 33g và 21,6g.
Lời giải:
Đáp án: A
C3H6 + 9/2 O2 → 3CO2 + 3H2O
C3H8 + 5O2 → 3CO2 + 4H2O
nX = 0,25 mol ⇒ nCO2 = 0,25.3 = 0,75 mol; mCO2 = 0,75.44 = 33 gam;
mX = mC + mH ⇔ 21,8.2.0,25 = 0,75.12 + 2.nH2O
⇒ nH2O = 0,95mol; mH2O = 18.0,95 = 17,1 gam
Bài 5: Một hỗn hợp A gồm 2 hydrocarbon X, Y liên tiếp nhau trong cùng dãy đồng đẳng. Đốt cháy 11,2 lít hỗn hợp X thu được 57,2 gam CO2 và 23,4 gam H2O. CTPT X, Y và khối lượng của X, Y là:
A. 12,6 gam C3H6 và 11,2 gam C4H8.
B. 8,6 gam C3H6và 11,2 gam C4H8.
C. 5,6 gam C2H4 và 12,6 gam C3H6.
D. 2,8 gam C2H4 và 16,8 gam C3H6.
Lời giải:
Đáp án: C
nCO2 = 1,3 mol; nH2O = 1,3 mol ⇒ hydrocarbon là alkene; CTPT là:
CnH2n + 3n/2 O2 → nCO2 + nH2O
nX = 0,5 mol ⇒ ntb = 1,3/0,5 = 2,6 ⇒ 2 alkene là: C2H4, C3H6;
nC2H4 : nC3H6 = 2:3 ⇒ nC2H4 = 0,2 mol và nC3H6 = 0,3 mol
⇒ mC2H4 = 0,2.28 = 5,6 gam và mC3H6 = 0,3.42 = 12,6 gam
Bài 6: Đốt cháy hoàn toàn 0,2 mol hồn hợp X gồm một alkane và một alkene, thu được 0,35 mol CO2 và 0,4 mol H2O. Thành phần phần trăm số mol của alkene có trong X là
A.40% B. 50% C. 25% D. 75%
Lời giải:
Đáp án: D
CnH2n + 3n/2 O2 → nCO2 + nH2O
CnH2n+2 + (3n+1)/2 O2 → nCO2 + (n+1)H2O
nalkane = nH2O - nCO2 = 0,4 – 0,35 = 0,05 (mol)
nalkene = 0,2 – 0,05 = 0,15 mol → %Valkene = .100% = 75%
Bài 7: Đốt cháy hoàn toàn 0,1 mol hỗm hợp gồm CH4, C4H10 và C2H4 thu được 0,14 mol CO2 và 0,23 mol H2O. Số mol của alkane và alkene trong hỗn hợp lần lượt là
A. 0,09 và 0,01. B. 0,01 và 0,09.
C. 0,08 và 0,02 D. 0,07 và 0,04
Lời giải:
Đáp án: A
CnH2n + 3n/2 O2 → nCO2 + nH2O
CnH2n+2 + (3n+1)/2 O2 → nCO2 + (n+1) H2O → nalkane = 0,23 – 0,14 = 0,09 mol
⇒ nalkene = 0,1 – 0,09 = 0,01 mol
Bài 8: Đốt cháy hoàn toàn 2,7 gam alkadien liên hợp X, thu được 4,48 lít CO2 (đktc). Công thức cấu tạo của X là
A. CH2 = C = CH2 B. CH2 = C – CH = CH2.
C. CH2 = C(CH3) – CH = CH2 D. CH2 = CH – CH = CH2
Lời giải:
Đáp án: D
Đặt CTPT X là CnH2n-2 →
→ CTPT: C4H6
Bài 9: Đốt cháy hoàn toàn 2,24 lít khí X (đktc) gồm buta–1,3–diene và etan sau đó dẫn toàn bộ sản phẩm cháy hấp thụ vào dung dịch H2SO4 đặc thì khối lượng dung dịch axit tăng thêm bao nhiêu gam ?
A. 3,6 g. B. 5,4 g. C. 9,0 g. D. 10,8 g.
Lời giải:
Đáp án: B
nH2O = 3.nX = 3.0,1 = 0,3 mol ⇒ m↑ = mH2O = 0,3.18 = 5,4 gam
Bài 10: 2,24 lít hỗn hợp X gồm buta–1,3–diene và penta–1–3-diene (đktc) có thể tác dụng hết tối đa bao nhiêu lít dung dịch brom 0,10 M ?
A. 2 lít. B. 1 lít. C. 1,5 lít. D. 2,5 lít.
Lời giải:
Đáp án: A
nBr2 = 2nX = 0,2 mol ⇒ VBr2 = 0,2/0,1 = 2 lít
Bài 11: Đốt cháy 8 gam alkyne X, rồi hấp thụ hoàn toàn sản phẩm cháy vào dd Ca(OH)2 dư, thu được 60 gam kết tủa. CTPT của X là:
A. C2H2 B. C3H4 C. C5H8 D. C4H6
Lời giải:
Đáp án: B
CnH2n-2 + (3n-1)/2 O2 → nCO2 + (n-1)H2O
nCO2 = nCaCO3 = 0,6 mol ⇒ MX = 8n/0,6 = 40n/3 ⇒ n = 3
Bài 12: Đốt cháy hoàn toàn 1 thể tích A gồm C2H6 và C2H2 thu được CO2 và H2O có tỉ lệ mol là 1:1. Phần trăm thể tích mỗi khí trong hỗn hợp đầu lần lượt là
A. 50%, 50% B. 30%, 70% C. 25% ,75% D. 70% ,30%
Lời giải:
Đáp án: A
giả sử nA = 1 mol ; nC2H6 = x và nC2H2 = y; nH2O = nCO2 = 2 mol; x + y = 1 và 3x + y = 2 ⇒ x = 0,5 và y = 0,5 ⇒ %V
Bài 13: 1 mol hydrocarbon X đốt cháy cho ra 5 mol CO2, 1mol X phản ứng với 2 mol AgNO3/NH3. Xác định CTCT của X.
A. CH2=CH-CH2-C≡C-H C. CH2=CH-CH=CH-CH3
B. HC≡C-CH2- C≡C-H D. CH2=C=CH-CH-CH2
Lời giải:
Đáp án: B
CTPT X là CxHy; x= 5 ⇒ có 5 nguyên tử C; X có 2 liên kết 3 ở đầu mạch.
Bài 14: Đốt cháy hoàn toàn m gam hydrocarbon ở thể khí, mạch hở, nhẹ hơn không khí thu được 7,04 gam CO2. Sục m gam hydrocarbon này vào nước brom dư đến khi phản ứng hoàn toàn, thấy có 25,6 gam brom phản ứng. Giá trị của m là:
A. 2 gam. B. 4 gam. C. 10 gam D. 2,08 gam
Lời giải:
Đáp án: D
hydrocarbon là C2H2 (vì M < Mkk; nBr2 = 2nalkyne)
nBr2 = 0,16 mol; nCO2 = 0,16 mol; nalkyne = 0,08 mol; m = 0,08.26 = 2,08 gam.
Bài 15: Hỗn hợp X có tỉ khối so với H2 là 21 gồm propan, propene và propin. Khi đốt cháy hoàn toàn 0,1 mol X, tổng khối lượng của CO2 và H2O thu được là
A. 18,60 gam. B. 18,96 gam. C. 20,40 gam. D. 16,80 gam.
Lời giải:
Đáp án: A
nCO2 = 3nX = 3.0,1 = 0,3 mol; mX = 0,1.21.2 = 4,2 gam
⇒ nH2O = (4,2 – 0,3.12)/2 = 0,3 mol;
m = mCO2 + mH2O = 0,3.44 + 0,3.18 = 18,6 gam
C. Bài tập tự luyện
Câu 1: Hỗn hợp X gồm hai alkene kế tiếp nhau trong dãy đồng đẳng. Trộn một thể tích hỗn hợp X với một lượng vừa đủ khí oxygen để được một hỗn hợp Y rồi đem đốt cháy hoàn toàn thì thu được sản phẩm khí và hơi Z. Tỉ khối của Y so với Z là 744 : 713 (các thể tích khí đo ở cùng điều kiện nhiệt độ và áp suất). Công thức phân tử của 2 alkene là
A. C5H10 và C6H12.
B. C3H6 và C2H4.
C. C4H8 và C5H10.
D. C3H6 và C4H8.
Câu 2: Hỗn hợp X gồm hai alkene kế tiếp nhau trong dãy đồng đẳng. Trộn một thể tích hỗn hợp X với một lượng vừa đủ khí oxygen để được một hỗn hợp Y rồi đem đốt cháy hoàn toàn thì thu được sản phẩm khí và hơi Z. Tỉ khối của Y so với Z là 744 : 713. (Các thể tích khí đo ở cùng điều kiện nhiệt độ và áp suất). Công thức phân tử của 2 alkene là
A. C5H10 và C6H12.
B. C3H6 và C2H4.
C. C4H8 và C5H10.
D. C3H6 và C4H8.
Câu 3: Đốt cháy hoàn toàn 0,1 mol alkene X thu được CO2 và hơi nước. Hấp thụ hoàn toàn sản phẩm bằng 100 gam dung dịch NaOH 21,62% thu được dung dịch mới trong đó nồng độ của NaOH chỉ còn 5%. Công thức phân tử đúng của X là
A. C2H4.
B. C3H6.
C. C4H8.
D. C5H10.
Câu 4: Đốt cháy toàn toàn 1 alkyne thu được 26,4 gam CO2 và 7,2 gam H2O. Xác định CTPT của alkyne?
A. C2H4.
B. C3H4.
C. C4H6.
D. C5H8.
Câu 5: Đốt cháy hoàn toàn 1 alkyne X bằng lượng oxygen vừa đủ. Toàn bộ sản phẩm cháy cho vào bình đựng dung dịch Ca(OH)2 dư thấy khối lượng bình tăng 28,75 gam và thu được 50 gam kết tủa. Xác định CTPT của X?
A. C2H4.
B. C3H4.
C. C4H6.
D. C5H8.
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Xem thêm các dạng bài tập Hóa học lớp 11 có trong đề thi Tốt nghiệp THPT khác:
- Dạng 1: Bài tập tính chất hóa học của alkene, alkadien, alkyne
- Dạng 2: Dạng bài tập Đồng phân, danh pháp của alkene, alkadien, alkyne
- Dạng 3: Phản ứng cộng của alkene, alkadien, alkyne
- Dạng 5: Phản ứng oxi hóa alkene, alkadien, alkyne
- Dạng 6: Phản ứng của alkyne với AgNO3 (Phản ứng thế hidro của Ank-1-yne)
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 11 Global Success
- Giải sgk Tiếng Anh 11 Smart World
- Giải sgk Tiếng Anh 11 Friends Global
- Lớp 11 - Kết nối tri thức
- Soạn văn 11 (hay nhất) - KNTT
- Soạn văn 11 (ngắn nhất) - KNTT
- Giải sgk Toán 11 - KNTT
- Giải sgk Vật Lí 11 - KNTT
- Giải sgk Hóa học 11 - KNTT
- Giải sgk Sinh học 11 - KNTT
- Giải sgk Lịch Sử 11 - KNTT
- Giải sgk Địa Lí 11 - KNTT
- Giải sgk Giáo dục KTPL 11 - KNTT
- Giải sgk Tin học 11 - KNTT
- Giải sgk Công nghệ 11 - KNTT
- Giải sgk Hoạt động trải nghiệm 11 - KNTT
- Giải sgk Giáo dục quốc phòng 11 - KNTT
- Giải sgk Âm nhạc 11 - KNTT
- Lớp 11 - Chân trời sáng tạo
- Soạn văn 11 (hay nhất) - CTST
- Soạn văn 11 (ngắn nhất) - CTST
- Giải sgk Toán 11 - CTST
- Giải sgk Vật Lí 11 - CTST
- Giải sgk Hóa học 11 - CTST
- Giải sgk Sinh học 11 - CTST
- Giải sgk Lịch Sử 11 - CTST
- Giải sgk Địa Lí 11 - CTST
- Giải sgk Giáo dục KTPL 11 - CTST
- Giải sgk Hoạt động trải nghiệm 11 - CTST
- Giải sgk Âm nhạc 11 - CTST
- Lớp 11 - Cánh diều
- Soạn văn 11 Cánh diều (hay nhất)
- Soạn văn 11 Cánh diều (ngắn nhất)
- Giải sgk Toán 11 - Cánh diều
- Giải sgk Vật Lí 11 - Cánh diều
- Giải sgk Hóa học 11 - Cánh diều
- Giải sgk Sinh học 11 - Cánh diều
- Giải sgk Lịch Sử 11 - Cánh diều
- Giải sgk Địa Lí 11 - Cánh diều
- Giải sgk Giáo dục KTPL 11 - Cánh diều
- Giải sgk Tin học 11 - Cánh diều
- Giải sgk Công nghệ 11 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 11 - Cánh diều
- Giải sgk Giáo dục quốc phòng 11 - Cánh diều
- Giải sgk Âm nhạc 11 - Cánh diều

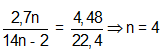



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

