Cách xác định thành phần cấu tạo nguyên tử (cực hay, có đáp án)
Bài viết Cách xác định thành phần cấu tạo nguyên tử với phương pháp giải chi tiết giúp học sinh ôn tập, biết cách làm bài tập Cách xác định thành phần cấu tạo nguyên tử.
Cách xác định thành phần cấu tạo nguyên tử (cực hay, có đáp án)
Thi online KHTN 8 KNTTThi online KHTN 8 CDThi online KHTN 8 CTST
A. Lý thuyết & Phương pháp giải
- Nguyên tử là hạt vô cùng nhỏ và trung hòa về điện. Nguyên tử gồm hạt nhân mang điện tích dương và vỏ tạo bởi một hay nhiều electron mang điện tích âm.
- Hạt nhân tạo bởi proton và neutron.
- Trong nguyên tử số proton (p, điện tích +) bằng số electron (e, điện tích -).
Số p = số e
- Electron luôn chuyển động quanh hạt nhân và sắp xếp thành từng lớp, mỗi lớp có một số electron nhất định.
Chẳng hạn sơ đồ sau minh họa thành phần cấu tạo của nguyên tử Na:
Chú ý: Cách giải bài tập xác định thành phần các hạt có trong nguyên tử khi biết tổng, hiệu và tỉ lệ các hạt.
Bước 1: Đặt ẩn:
Gọi các hạt proton, neutron và electron có trong nguyên tử lần lượt là p, n và e.
Do nguyên tử trung hòa và điện nên p = e.
Bước 2: Dựa vào dữ kiện đề bài lập các phương trình. Lưu ý:
+) Tổng các hạt trong nguyên tử = p + n + e.
+) Tổng các hạt trong hạt nhân nguyên tử = p + n.
+) Tổng các hạt mang điện trong nguyên tử = p + e.
Bước 3: Kết hợp các phương trình, giải ra nghiệm p, n, e và kết luận theo yêu cầu đề bài.
B. Ví dụ minh họa
Ví dụ 1: Tổng số hạt trong một nguyên tử X là 40, số hạt mang điện nhiều hơn số hạt không mang điện là 12 hạt. Hỏi nguyên tử X có bao nhiêu hạt neutron?
Lời giải:
Gọi các hạt proton, neutron và electron trong X lần lượt là p, n và e.
Tổng số hạt trong nguyên tử X là 40 nên p + n + e = 40 (1)
Mà nguyên tử trung hòa về điện nên p = e thay vào (1) ta được:
2p + n = 40 (2)
Trong nguyên tử X, số hạt mang điện nhiều hơn số hạt không mang điện là 12 nên:
(p + e) – n = 12 hay 2p – n = 12 (3)
Từ (2) và (3) ta sử dụng máy tính giải hệ phương trình được: p = 13 và n = 14.
Vậy X có 14 neutron trong nguyên tử.
Chú ý: Trong trường hợp các em học sinh lớp 8 chưa học hệ phương trình, có thể giải như sau:
Lấy (2) + (3) được 4p = 52 → p = 13.
Thay p = 13 vào (2) hoặc (3) được n = 14.
Ví dụ 2: Nguyên tử được tạo thành từ ba loại hạt nhỏ hơn nữa (gọi là hạt dưới nguyên tử), đó là những loại hạt nào? Hãy nêu kí hiệu và điện tích của các loại hạt đó.
Lời giải:
- Nguyên tử được tạo thành từ ba loại hạt nhỏ hơn nữa là proton, neutron và electron.
- Trong đó:
+ Proton kí hiệu là p, mang điện tích dương.
+ Electron kí hiệu là e, mang điện tích âm.
+ neutron kí hiệu là n, không mang điện tích.
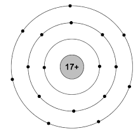
Ví dụ 3: Cho sơ đồ minh họa cấu tạo của nguyên tử clo như sau:
Hãy chỉ ra số proton trong hạt nhân, số electron trong nguyên tử, số lớp electron và số electron lớp ngoài cùng của nguyên tử clo.
Lời giải:
Quan sát vào sơ đồ xác định được:
- Clo có số proton = số electron = 17.
- Clo có 3 lớp electron trong nguyên tử và lớp ngoài cùng có 7 electron.
C. Bài tập vận dụng
Câu 1: Các hạt cấu tạo nên hạt nhân của hầu hết nguyên tử là:
A. electron, proton và neutron.
B. electron và neutron.
C. proton và neutron.
D. electron và proton.
Lời giải:
Chọn C.
Câu 2: Các hạt cấu tạo nên hầu hết các nguyên tử là:
A. electron, proton và neutron.
B. electron và neutron.
C. proton và neutron.
D. electron và proton.
Lời giải:
Chọn A.
Câu 3: Trong nguyên tử, hạt mang điện là:
A. Electron.
B. Electron và neutron.
C. Proton và nơton.
D. Proton và electron.
Lời giải:
Chọn D.
Câu 4: Hạt mang điện trong hạt nhân nguyên tử là:
A. Electron.
B. Proton.
C. neutron.
D. neutron và electron.
Lời giải:
Chọn B.
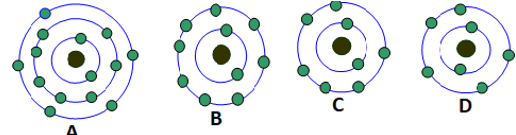
Câu 5: Có bao nhiêu nguyên tử trong hình vẽ dưới đây có số electron lớp ngoài cùng là 5?
A. 3.
B. 2.
C. 1.
D. 4.
Lời giải:
Nguyên tử A và D có 5 electron ở lớp ngoài cùng.
Nguyên tử B có 8 electron ở lớp ngoài cùng.
Nguyên tử C có 6 electron ở lớp ngoài cùng.
Chọn B.
Câu 6: Nguyên tử của nguyên tố X có tổng số hạt proton, neutron, electron là 36, trong đó số hạt mang điện gấp đôi số hạt không mang điện. Số hạt proton của X là:
A. 10.
B. 12.
C. 15.
D. 18.
Lời giải:
Chọn B.
Gọi số hạt proton, neutron và electron trong X lần lượt là p, n và e.
X có tổng số hạt là 36 nên p + n + e = 36 (1).
Mà nguyên tử trung hòa về điện nên p = e, thay vào (1) ta được: 2p + n = 36 (2).
Trong nguyên tử X, hạt mang điện gấp đôi số hạt không mang điện nên:
(p + e) = 2n hay p = n (3)
Thay (3) vào (2) được p = n = 12.
Vậy số hạt proton của X là 12.
Câu 7: Một nguyên tử có 9 electron ở lớp vỏ, hạt nhân của nó có 10 neutron. Tổng các hạt proton, neutron và electron có trong nguyên tử là:
A. 9.
B. 18.
C. 19.
D. 28.
Lời giải:
Chọn D.
Số proton = số electron = 9.
⇒ p + n + e = 2e + n = 2.9 + 10 = 28 (hạt).
Câu 8: Nguyên tử A có tổng số hạt mang điện và hạt không mang điện là 28, trong đó số hạt mang điện gấp 1,8 lần số hạt không mang điện. A là:
A. Ar.
B. Ne.
C. F.
D. O.
Lời giải:
Chọn C.
Gọi số hạt proton, neutron và electron có trong nguyên tử A lần lượt là p, n và e.
Mà nguyên tử trung hòa về điện nên p = e.
Theo bài ra có:
Bấm máy tính giải hệ phương trình (*) hoặc (lấy phương trình trên trừ phương trình dưới) ta được: n = 10 và p = 9.
Vậy A là flo (F) vì nguyên tử F có 9 proton trong hạt nhân.
Câu 9: Nguyên tử của nguyên tố X có tổng số hạt bằng 73. Số hạt neutron nhiều hơn số hạt electron là 4. Tổng số hạt mang điện có trong nguyên tử là
A. 46.
B. 50.
C. 54.
D. 51.
Lời giải:
Chọn A.
Gọi số hạt proton, neutron và electron có trong nguyên tử X lần lượt là p, n và e.
Nguyên tử trung hòa về điện nên số p = số e.
Theo bài ra ta có:
Giải hệ phương trình được p = 23 và n = 27.
Số hạt mang điện trong nguyên tử là: p + e = 2p = 46 (hạt).
Câu 10: Nguyên tử của nguyên tố X có tổng số hạt là 28. Trong đó số hạt không mang điện chiếm khoảng 35,71% tổng các loại hạt. X là
A. S.
B. N.
C. F.
D. O.
Lời giải:
Chọn C.
Gọi số hạt proton, neutron và electron có trong nguyên tử X lần lượt là p, n và e.
Nguyên tử trung hòa về điện nên số p = số e.
Nguyên tử có tổng số hạt là 28 nên p + e + n = 28
Hay 2p + n = 28 (1).
Số hạt không mang điện chiếm khoảng 35,71% tổng các loại hạt
Thay n = 10 vào (1) được p = 9.
Vậy X là flo (F) vì nguyên tử F có 9 proton trong hạt nhân.
Thi online KHTN 8 KNTTThi online KHTN 8 CDThi online KHTN 8 CTST
Xem thêm các dạng bài tập Hóa học lớp 8 có đáp án hay khác:
- Cách giải bài tập tính khối lượng nguyên tử (cực hay, có đáp án)
- Cách giải bài tập phân biệt đơn chất và hợp chất (cực hay, chi tiết)
- Xác định công thức hóa học của đơn chất, hợp chất và tính phân tử khối của hợp chất
- Cách giải bài tập xác định hóa trị của một nguyên tố (cực hay)
- Cách lập công thức hóa học của một chất theo hóa trị (cực hay)
Tủ sách VIETJACK shopee lớp 6-8 (2025):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài Lý thuyết - Bài tập Hóa học lớp 8 có đáp án được biên soạn bám sát nội dung chương trình sgk Hóa học 8.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 8 Global Success
- Giải sgk Tiếng Anh 8 Smart World
- Giải sgk Tiếng Anh 8 Friends plus
- Lớp 8 - Kết nối tri thức
- Soạn văn 8 (hay nhất) - KNTT
- Soạn văn 8 (ngắn nhất) KNTT
- Giải sgk Toán 8 - KNTT
- Giải sgk Khoa học tự nhiên 8 - KNTT
- Giải sgk Lịch Sử 8 - KNTT
- Giải sgk Địa Lí 8 - KNTT
- Giải sgk Giáo dục công dân 8 - KNTT
- Giải sgk Tin học 8 - KNTT
- Giải sgk Công nghệ 8 - KNTT
- Giải sgk Hoạt động trải nghiệm 8 - KNTT
- Giải sgk Âm nhạc 8 - KNTT
- Lớp 8 - Chân trời sáng tạo
- Soạn văn 8 (hay nhất) - CTST
- Soạn văn 8 (ngắn nhất) - CTST
- Giải sgk Toán 8 - CTST
- Giải sgk Khoa học tự nhiên 8 - CTST
- Giải sgk Lịch Sử 8 - CTST
- Giải sgk Địa Lí 8 - CTST
- Giải sgk Giáo dục công dân 8 - CTST
- Giải sgk Tin học 8 - CTST
- Giải sgk Công nghệ 8 - CTST
- Giải sgk Hoạt động trải nghiệm 8 - CTST
- Giải sgk Âm nhạc 8 - CTST
- Lớp 8 - Cánh diều
- Soạn văn 8 Cánh diều (hay nhất)
- Soạn văn 8 Cánh diều (ngắn nhất)
- Giải sgk Toán 8 - Cánh diều
- Giải sgk Khoa học tự nhiên 8 - Cánh diều
- Giải sgk Lịch Sử 8 - Cánh diều
- Giải sgk Địa Lí 8 - Cánh diều
- Giải sgk Giáo dục công dân 8 - Cánh diều
- Giải sgk Tin học 8 - Cánh diều
- Giải sgk Công nghệ 8 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 8 - Cánh diều
- Giải sgk Âm nhạc 8 - Cánh diều


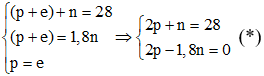
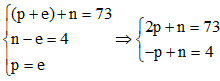
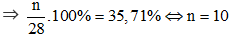



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

