15+ Bài tập về Nhôm lớp 9 (có lời giải)
Tổng hợp trên 15 Bài tập về Nhôm Hóa học lớp 9 có lời giải chi tiết gồm các câu hỏi & bài tập trắc nghiệm đầy đủ các mức độ nhận biết, thông hiểu, vận dụng sẽ giúp học sinh biết cách làm bài tập Hóa 9.
15+ Bài tập về Nhôm lớp 9 (có lời giải)
Thi online KHTN 9 KNTTThi online KHTN 9 CDThi online KHTN 9 CTST
A/ Bài tập lí thuyết về nhôm
Bài 1: Nhôm là kim loại
A. dẫn điện và nhiệt tốt nhất trong số tất cả kim loại.
B. dẫn điện và nhiệt đều kém.
C. dẫn điện tốt nhưng dẫn nhiệt kém.
D. dẫn điện và nhiệt tốt nhưng kém hơn đồng.
Lời giải
Nhôm là kim loại dẫn điện và nhiệt tốt nhưng kém hơn đồng.
Thứ tự dẫn điện, dẫn nhiệt: Ag, Cu, Au, Al, Fe,…
Đáp án: D
Bài 2: Người ta có thể dát mỏng được nhôm thành thìa, xoong, chậu, giấy gói bánh kẹo là do nhôm có tính :
A. dẻo
B. dẫn điện
C. dẫn nhiệt
D. ánh kim
Lời giải
Người ta có thể dát mỏng được nhôm thành thìa, xoong, chậu, giấy gói bánh kẹo là do nhôm có tính dẻo
Đáp án: A
Bài 3: Một kim loại có khối lượng riêng là 2,7 g/cm3, nóng chảy ở 6600C. Kim loại đó là:
A. sắt
B. nhôm
C. đồng
D. bạc
Lời giải
Một kim loại có khối lượng riêng là 2,7 g/cm3, nóng chảy ở 6600C => kim loại là Al
Đáp án: B
Bài 4: Nhôm bền trong không khí là do
A. nhôm nhẹ, có nhiệt độ nóng chảy cao.
B. nhôm không tác dụng với nước.
C. nhôm không tác dụng với oxi.
D. có lớp nhôm oxit mỏng bảo vệ.
Lời giải
Nhôm bền trong không khí là do có lớp nhôm oxit mỏng bảo vệ.
Đáp án: D
Bài 5: Một kim loại có những tính chất (vật lí và hóa học) như sau:
- Hợp kim của nó với các kim loại khác, được ứng dụng trong công nghệ chế tạo máy bay, tên lửa.
- Phản ứng mãnh liệt với hydrochloric acid.
- Phản ứng với dung dịch kiềm, giải phóng khí hiđro
- Nhẹ, dẫn điện và dẫn nhiệt tốt. Đó là kim loại:
A. kẽm
B. vàng
C. nhôm
D. chì
Lời giải
Vì là kim loại phản ứng với dung dịch kiềm, giải phóng khí hiđro và nhẹ dẫn điện, dẫn nhiệt tốt
=> kim loại đó là Al
Đáp án: C
Bài 6: X là kim loại nhẹ, dẫn điện tốt , phản ứng mạnh với dung dịch HCl, tan trong dung dịch kiềm và giải phóng H2. X là:
A. Al
B. Mg
C. Cu
D. Fe
Lời giải
Đáp án A
Bài 7: Giải thích tại sao để điều chế Al người ta điện phân Al2O3 nóng chảy mà không điện phân AlCl3 nóng chảy là:
A. AlCl3 nóng chảy ở nhiệt độ cao hơn Al2O3.
B. AlCl3 không nóng chảy mà thăng hoa.
C. Điện phân AlCl3 tạo ra Cl2 rất độc.
D. Điện phân Al2O3 cho ra Al tinh khiết hơn.
Lời giải
Để điều chế Al người ta điện phân Al2O3 nóng chảy mà không điện phân AlCl3 nóng chảy vì AlCl3 không nóng chảy mà thăng hoa.
Đáp án: B
Bài 8: Trong công nghiệp người ta điều chế nhôm bằng cách
A. Khử Al2O3 bằng khí CO.
B. Khử Al2O3 bằng khí H2.
C. dùng Na tác dụng với dung dịch AlCl3.
D. điện phân nóng chảy Al2O3/criolit.
Lời giải
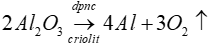
Đáp án: D
Bài 9: Nguyên liệu chính để sản xuất nhôm là:
A. criolit
B. quặng boxit
C. điện
D. than chì
Lời giải
Nguyên liệu chính để sản xuất nhôm là quặng boxit (Al2O3)
Đáp án: B
Bài 10: Khi điện phân Al2O3 nóng chảy người ta thêm criolit (Na3AlF6) với mục đích:
1. Làm hạ nhiệt độ nóng chảy của Al2O3.
2. Làm cho tính dẫn điện cao hơn.
3. Để thu được F2 ở anot thay vì là O2.
4. Tạo hỗn hợp nhẹ hơn Al để bảo vệ Al.
Các lý do nêu đúng là:
A. Chỉ có 1 B. 1 và 2
C. 1 và 3 D. 1, 2 và 4
Lời giải
Khi điện phân Al2O3 nóng chảy người ta thêm criolit (Na3AlF6) với mục đích:
1. Làm hạ nhiệt độ nóng chảy của Al2O3.
2. Làm cho tính dẫn điện cao hơn.
4. Tạo hỗn hợp nhẹ hơn Al để bảo vệ Al.
Đáp án: D
Bài 11: Cho các kim loại: Cu, Zn, Fe, Mg, Ag, Al. Những kim loại nào không tác dụng với dd HNO3 đặc nguội?
A. Fe, Mg, Ag, Al.
B. Cu, Mg, Ag, Al.
C. Fe, Al.
D. Tất cả các kim loại
Lời giải
2 kim loại không phản ứng với dung dịch HNO3 đặc nguội là Fe và Al
Đáp án: C
Bài 12: Cho các phát biểu về phản ứng nhiệt nhôm, phát biểu đúng là
A. Nhôm chỉ có thể khử các oxit kim loại đứng sau H trong dãy hoạt động hóa học.
B. Nhôm chỉ có thể khử các oxit kim loại đứng sau Al trong dãy hoạt động hóa học.
C. Nhôm chỉ có thể khử các oxit kim loại đứng trước và đứng sau Al trong dãy hoạt động hóa học với điều kiện kim loại đó dễ bay hơi.
D. Nhôm khử tất cả các oxit kim loại.
Lời giải
Phát biểu đúng là: Nhôm chỉ có thể khử các oxit kim loại đứng sau Al trong dãy hoạt động hóa học.
Đáp án: B
Bài 13: Chỉ dùng 1 chất để phân biệt 3 kim loại sau: Al, Ba, Mg?
A. Dung dịch HCl
B. Nước
C. Dung dịch NaOH
D. Dung dịch H2SO4
Lời giải
Để phân biệt 3 kim loại Al, Ba, Mg ta dùng nước. Cho nước vào 3 mẫu kim loại, kim loại tốt trong nước và sủi bọt khí là Ba, 2 kim loại không tan trong nước là Al và Mg.
Ba + 2H2O → Ba(OH)2 + H2 ↑
- Lấy dung dịch Ba(OH)2 vừa thu được đổ vào mẫu 2 kim loại còn lại, kim loại nào tan, sủi bọt khí là Al, kim loại không có hiện tượng gì là Mg
2Al + Ba(OH)2 + 2H2O → Ba(AlO2)2 + 3H2 ↑
Đáp án: B
Bài 14: Chỉ dùng nước nhận biết được 3 chất rắn riêng biệt nào?
A. Al, Fe, Cu
B. Al, Na, Fe
C. Fe, Cu, Zn
D. Ag, Cu, Fe
Lời giải
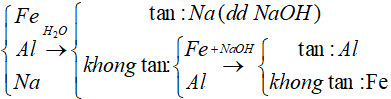
Đáp án: B
Bài 15: Có 3 lọ không nhãn, mỗi lọ đựng một trong các chất rắn sau: Cu, Mg, Al. Thuốc thử để nhận biết 3 chất trên là:
A. Lần lượt NaOH và HCl.
B. Lần lượt là HCl và H2SO4 loãng.
C. Lần lượt NaOH và H2SO4 đặc nóng.
D. Tất a, b, c đều đúng.
Lời giải
Dể nhận biết 3 chất rắn trên thì ta dùng lần lượt dung dịch NaOH và HCl.
- Cho dung dịch NaOH vào 3 ống nghiệm đựng chất rắn, chất rắn nào tan và sủi bọt khí là Al, 2 ống không hiện tượng là Cu và Mg
PTHH: 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2 ↑
- Cho dung dịch HCl vào 2 chất rắn còn lại, chất rắn nào tan và sủi bọt khí là Mg, chất rắn không hiện tượng là Cu
PTHH: Mg + 2HCl → MgCl2 + H2↑
Đáp án: A
B/ Bài tập nhôm và hợp chất của nhôm tác dụng với dung dịch kiềm
Bài 1: Hòa tan 2,7 gam Al vào dung dịch NaOH dư thu được V lít khí thoát ra ở đktc. Giá trị của V là
A. 2,24
B. 3,36
C. 4,48
D. 5,60
Lời giải
nAl = 0,1 mol
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
0,1 mol → 0,15 mol
⇒ VH2 = 0,15.22,4 = 3,36 lít
Đáp án: B
Bài 2: Hoà tan hỗn hợp A gồm 13,7 gam Ba và 5,4 gam Al vào một lượng nước có dư thì thể tích khí thoát ra ở điều kiện tiêu chuẩn là
A. 6,72 lít
B. 8,96 lít
C. 13,44 lít
D. 4,48 lít
Lời giải
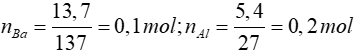
Ba + 2H2O → Ba(OH)2 + H2↑
0,1 mol → 0,1 mol → 0,1 mol
2Al + Ba(OH)2 + 2H2O → Ba(AlO2)2 + 3H2↑
0,2 ← 0,1 mol → 0,3 mol
⇒∑nH2 = 0,1 + 0,3 = 0,4 ⇒ VH2 = 0,4.22,4 = 8,96
Đáp án: B
Bài 3: Trộn dung dịch chứa a mol AlCl3 với dung dịch chứa b mol NaOH. Để thu được kết tủa thì cần có tỉ lệ
A. a : b = 1 : 4
B. a : b < 1 : 4
C. a : b = 1 : 5
D. a : b > 1 : 4
Lời giải
AlCl3 + 3NaOH → Al(OH)3↓ + 3NaCl
a → 3a → a
Al(OH)3 + NaOH → NaAlO2 + 2H2O
a → a
Nếu nNaOH = 4a thì kết tủa sẽ tan hết => để có kết tủa thì: nNaOH < 4a => b < 4a
=> a : b > 1 : 4
Đáp án: D
Bài 4: TN1: Nhỏ từ từ V1 lít dung dịch Ba(OH)2 xM (dung dịch X) vào V2 lít dung dịch ZnSO4 y M (dung dịch Y) thì phản ứng vừa đủ và thu được kết tủa lớn nhất.
TN2: Nếu nhỏ từ từ V2 lít dung dịch X vào V2 lít dung dịch Y (ở trên) thì phản ứng vừa đủ và thu được kết tủa nhỏ nhất.
Xác định giá trị x/y và V1/ V2?
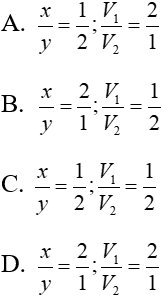
Lời giải
TN1: Ba(OH)2 + ZnSO4 BaSO4↓ + Zn(OH)2↓ (1)
V1x V2y
Ta có: V1x=V2y (*)(vì phản ứng vừa đủ)
Theo (1): nZn(OH)2 = nZnSO4 = V2y (mol)
TN2: xảy ra pư (1) và pư:
Ba(OH)2 + Zn(OH)2↓ → BaZnO2 +H2O (2)
V2y ← V2y
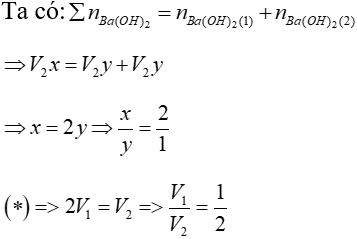
Đáp án: B
Bài 5: Cho 5,4 gam bột nhôm vào 200 ml dung dịch NaOH, sau phản ứng thấy khối lượng dung dịch tăng 3,6 gam. Nồng độ mol/lít của dung dịch NaOH là
A. 0,45M
B. 1,00M
C. 0,75M
D. 0,50M
Lời giải
nAl = 0,2 mol
Gọi số mol Al phản ứng là x mol
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
x → x → 1,5x
Khối lượng dung dịch tăng 3,6 gam => ∆mtăng = mAl – mH2 = 3,6 gam
=> 27x – 1,5x.2 = 3,6 => x = 0,15 mol
Theo PT: nNaOH = nAlphản ứng = 0,15 mol
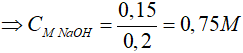
Đáp án: C
Bài 6: Để hòa tan hoàn toàn m gam Al cần dùng 100 ml dung dịch chứa NaOH 1M và Ba(OH)2 0,5M. Giá trị của m là
A. 5,4 gam
B. 3,6 gam
C. 7,2 gam
D. 4,5 gam
Lời giải
nNaOH = 0,1 mol; nBa(OH)2 = 0,05 mol
PTHH:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
0,1 ← 0,1 mol
2Al + Ba(OH)2 + 2H2O → Ba(AlO2)2 + 3H2↑
0,1 ← 0,05 mol
=> ∑nAlphản ứng = 0,1 + 0,1 = 0,2 mol => mAl = 0,2.27 = 5,4 gam
Đáp án: A
Bài 7: Hòa tan a gam hỗn hợp Mg và Al bằng dung dịch HCl thu được 17,92 lít H2 (đktc). Cũng hỗn hợp trên hòa tan hoàn toàn trong dung dịch NaOH dư thu được 13,44 lít H2 (đktc). Giá trị của a là
A. 3,9
B. 7,8
C. 11,7
D. 15,6
Lời giải
Hòa tan trong NaOH => chỉ có Al phản ứng
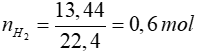
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
0,4 mol ← 0,6 mol
Hòa tan trong HCl cả 2 kim loại đều tạo khí
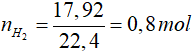
2Al + 6HCl → 2AlCl3 + 3H2
0,4 mol → 0,6 mol
Mg + 2HCl → MgCl2 + H2
0,2 mol ← 0,2 mol
=> a = mAl + mMg = 0,4.27 + 24.0,2 = 15,6 gam
Đáp án: D
Bài 8: Cho hỗn hợp gồm Na và Al có tỉ lệ số mol tương ứng là 1 : 2 vào nước dư. Sau khi các phản ứng xảy ra hoàn toàn, thu được 8,96 lít khí H2 (ở đktc) và m gam chất rắn không tan. Giá trị của m là
A. 5,4
B. 10,8
C. 7,8
D. 43,2
Lời giải
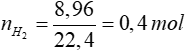
Gọi số mol Na là a mol => số mol của Al là 2a mol
m gam chất rắn không tan là Al => Al dư sau phản ứng với NaOH
2Na + 2H2O → 2NaOH + H2↑
a → a → 0,5a
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
a ← a → 1,5a
⇒∑nH2 = 0,5a + 1,5a = 0,4 ⇒ a = 0,2
=> nAl dư = 2a – a = a = 0,2 => m = 5,4 gam
Đáp án: A
Bài 9: Hòa tan hỗn hợp A gồm 13,7g Ba và 5,4g Al vào một lượng nước dư thì thể tích khí thoát ra ở đktc là:
A. 6,72 lít
B. 4,48 lít
C. 13,44 lít
D. Một kết quả khác
Lời giải
nBa =0,1 mol
nAl = 0,2 mol
Ta có
Ba + 2H2O → Ba(OH)2 + H2
0,1 mol →0,1 mol 0,1 mol
Ba(OH)2 + 2Al +2H2O → Ba(AlO2)2 + 3H2
Ban đầu 0,1 mol 0,2 mol
Sau pư 0 0 0,3 mol
→nH2= 0,4 mol → V =8,96 lít
Đáp án: D
Bài 10: Hỗn hợp X gồm K và Al. Cho 12 gam hỗn hợp X vào một lượng dư nước thì thoát ra 4,48 lít khí H2 (đktc) và còn lại một phần chất rắn chưa tan. Nếu cho m gam hỗn hợp X vào dung dịch KOH dư thì thu được bao nhiêu lít khí H2 (đktc)?
A. 6,72 lít
B. 11,2 lít
C. 4,48 lít
D. 8,96 lít
Lời giải
Phần chất rắn chưa tan là Al còn dư
Gọi nK = x mol
Cho hỗn hợp X vào nước, K phản ứng hết tạo KOH và Al phản ứng với KOH và còn dư => tính số mol theo KOH
2K + 2H2O → 2KOH + H2
x → x → 0,5x
2Al + 2KOH + 2H2O → 2KAlO2 + 3H2
x ← x → 1,5x
⇒∑nH2 = 0,5x + 1,5x = 0,2 ⇒ x= 0,1 mol
Ta có: mhhX = mK + mAlphản ứng + mAldư
=> mAldư = 12 – 0,1.39 – 0,1.27 = 5,4 gam
=> nAltronghh X = 0,1 + 0,2 = 0,3 mol
Cho hỗn hợp X tác dụng với dung dịch KOH dư => K phản ứng hết với H2O và Al phản ứng hết với KOH
2K + 2H2O → 2KOH + H2
0,1 mol → 0,05 mol
2Al + 2KOH + 2H2O → 2KAlO2 + 3H2
0,3 mol → 0,45 mol
⇒∑nH2 = 0,05 + 0,45 = 0,5 ⇒ V = 11,2
Đáp án: B
Bài 11: Cho 200 ml dung dịch NaOH 2M tác dụng hoàn toàn với 200 ml dung dịch AlCl3 aM. Sau phản ứng thu được 7,8 gam kết tủa aluminum hydroxide. Giá trị của a là:
A. 0,5M B. 0,625M
C. 2M D. Cả A và B
Lời giải
3NaOH + AlCl3 → 3NaCl + Al(OH)3 (1)
NaOH + Al(OH)3 → NaAlO2 + 2H2O (2)
Theo đề bài ta có: nNaOH = 0,4 mol; nAlCl3 = 0,2a (mol); nAl(OH)3= 7,8 : 78 = 0,1 mol
Vì nNaOH > 3nAl(OH)3 nên sau phản ứng (1) dư NaOH => xảy ra cả phản ứng (2)
3NaOH + AlCl3 → 3NaCl + Al(OH)3 (1)
Bđ: 0,4 0,2a
Pư: 0,6a ← 0,2a → 0,2a
Sau: 0,4-0,6a 0 0,2a
NaOH + Al(OH)3 → NaAlO2 + 2H2O (2)
Bđ: 0,4-0,6a 0,2a
Pư: 0,4-0,6a → 0,4-0,6a
Sau: 0 0,8a-0,4
Sau phản ứng ta thu được 0,1 mol kết tủa => 0,8a - 0,4 = 0,1 => a = 0,625
Đáp án: B
Bài 12: Hỗn hợp X gồm Na và Al. Cho m gam X vào một lượng dư nước thì thoát ra V lít khí. Nếu cũng cho m gam X vào dung dịch NaOH dư thì được 1,75V lít khí. Thành phần phần trăm theo khối lượng của Na trong X là
A. 39,87%. B. 77,31%.
C. 29,87%. D. 49,87%.
Lời giải
Gọi số mol của Na và Al trong hỗn hợp X lần lượt là x và y mol
Vì tỉ lệ thể tích cũng là tỉ lệ số mol => coi như thí nghiệm 1 thu được a mol khí và thí nghiệm 2 thu được 1,75a mol
Cho hỗn hợp X vào nước, Na phản ứng hết tạo NaOH và Al phản ứng với NaOH và còn dư => tính số mol theo NaOH
2Na + 2H2O → 2NaOH + H2
x → x → 0,5x
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
x ← x → 1,5x
⇒∑nH2 = 0,5x + 1,5x = a ⇒ x = 0,5a
Cho hỗn hợp X tác dụng với dung dịch NaOH dư => Na phản ứng hết với H2O và Al phản ứng hết với NaOH
2Na + 2H2O → 2NaOH + H2
x mol → 0,5x mol
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
y mol → 1,5y mol
⇒∑nH2 = 0,5x + 1,5y = 1,75a
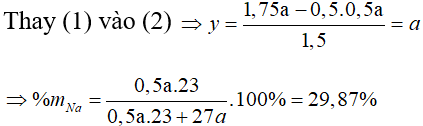
Đáp án: C
C/ Bài tập phản ứng nhiệt nhôm
Bài 1: Hỗn hợp X gồm Fe3O4 và Al có tỉ lệ mol tương ứng 1 : 3. Thực hiện phản ứng nhiệt nhôm X (không có không khí) đến khi phản ứng xảy ra hoàn toàn thu được hỗn hợp gồm
A. Al, Fe, Fe3O4 và Al2O3.
B. Al2O3, Fe và Fe3O4.
C. Al2O3 và Fe.
D. Al, Fe và Al2O3
Lời giải
Giả sử ban đầu lấy 1 mol Fe3O4 và 3 mol Al
8Al + 3Fe3O4 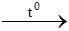 4Al2O3 + 9Fe
4Al2O3 + 9Fe
Xét tỉ lệ: 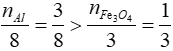
=> Fe3O4 phản ứng hết, Al dư
=> hỗn hợp sau phản ứng thu được: Al dư, Fe và Al2O3
Đáp án: D
Bài 2: Trộn 8,1 gam Al và 48 gam Fe2O3 rồi cho tiến hành phản ứng nhiệt nhôm trong điều kiện không có không khí, phản ứng kết thúc thu được m gam hỗn hợp rắn. Giá trị của m là:
A. 56,1 gam. B. 61,5 gam.
C. 65,1 gam. D. 51,6 gam.
Lời giải
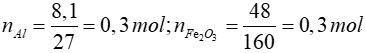
2Al + Fe2O3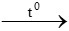 Al2O3 + 2Fe
Al2O3 + 2Fe
Bảo toàn khối lượng: mhhtrước phản ứng = mhhsau phản ứng
=> mhhsau phản ứng = 8,1 + 48 = 56,1 gam
Đáp án: A
Bài 3: Dùng m gam Al để khử hoàn toàn một lượng Fe2O3 sau phản ứng thấy khối lượng oxit giảm 0,58 gam. Giá trị của m là
A. 0,27 B. 2,70
C. 0,54 D. 1,12
Lời giải
Gọi số mol Al phản ứng là x mol
2Al + Fe2O3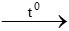 Al2O3 + 2Fe
Al2O3 + 2Fe
x → 0,5x → 0,5x
Oxit ban đầu là Fe2O3, oxit sau phản ứng là Al2O3
=> moxitgiảm = mFe2O3 - mAl2O3 = 0,58 gam
=> 0,5x.160 – 0,5x.102 = 0,58 => x = 0,02 mol
=> mAl = 0,02.27 = 0,54 gam
Đáp án: C
Bài 4: Dùng m gam Al để khử hết 1,6 gam Fe2O3 (phản ứng nhiệt nhôm). Sản phẩn sau phản ứng tác dụng với lượng dư dung dịch NaOH tạo ra 0,672 lít khí (đktc). Giá trị của m là
A. 1,755 B. 0,810
C. 1,080 D. 0,540
Lời giải
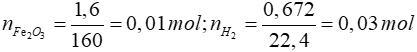
2Al + Fe2O3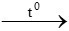 Al2O3 + 2Fe (1)
Al2O3 + 2Fe (1)
0,02 ← 0,01 mol
Khi Al dư thì:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2 (2)
0,02 mol ← 0,03 mol
=> ∑nAlban đầu = nAl(1) + nAl(2) = 0,02 + 0,02 = 0,04 mol
=> mAl = 0,04.27 = 1,08 gam
Đáp án: C
Bài 5: Trộn 6,48 gam Al với 16 gam Fe2O3. Thực hiện phản ứng nhiệt nhôm thu được chất rắn A. Khi cho A tác dụng dung dịch NaOH dư thu được 1,344 lít khí H2 (đktc). Hiệu suất phản ứng nhiệt nhôm (được tính theo chất thiếu) là
A. 100% B. 85%
C. 80% D. 75%
Lời giải
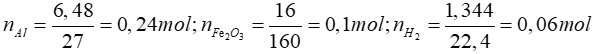
Phản ứng nhiệt nhôm: 2Al + Fe2O3 → Al2O3 + 2Fe (1)
Xét tỉ lệ: 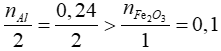
=> hiệu suất phản ứng tính theo Fe2O3
Al dư tác dụng với dung dịch NaOH tạo khí
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2 (2)
0,04 mol ← 0,06 mol
=> nAlphản ứng (1) = nAlban đầu – nAldư = 0,24 – 0,04 = 0,2 mol
phản ứng = 0,5.nAlphản ứng = 0,1 mol
=> Hiệu suất phản ứng là H = 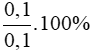 =100%
=100%
Đáp án: A
Bài 6: Tiến hành phản ứng nhiệt nhôm hỗn hợp X gồm Fe2O3 và Al trong điều kiện không có không khí thu được hỗn hợp chất rắn Y. Cho Y tác dụng với dung dịch NaOH dư sẽ thu được 0,3 mol H2. Mặt khác nếu cho Y tác dụng với dung dịch HCl dư sẽ thu được 0,4 mol H2. Số mol Al trong X là
A. 0,3 mol. B. 0,6 mol.
C. 0,4 mol. D. 0,25 mol.
Lời giải
Cho Y tác dụng với dung dịch NaOH dư sẽ thu được 0,3 mol H2 => trong Y chứa Al dư
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
0,2 mol ← 0,3 mol
=> nAldư = 0,2 mol
Y tác dụng với dung dịch HCl dư sẽ thu được 0,4 mol H2
2Al + 6HCl → AlCl3 + 3H2
0,2 mol → 0,3 mol
Fe + 2HCl → FeCl2 + H2
0,1 mol ← 0,1 mol
Phản ứng nhiệt nhôm:
2Al + Fe2O3 → Al2O3 + 2Fe
0,1 mol ← 0,1 mol
=> ∑nAlban đầu = nAldư + nAlphảnứng = 0,2 + 0,1 = 0,3 mol
Đáp án: A
Bài 7: Nung m gam hỗn hợp Al, Fe2O3 đến phản ứng hoàn toàn thu được hỗn hợp rắn Y. Chia Y làm 2 phần bằng nhau. Phần 1 tác dụng với dung dịch H2SO4 loãng dư, sinh ra 3,08 lít khí H2 ở đktc. Phần 2 tác dụng với dung dịch NaOH dư, sinh ra 0,84 lít khí H2 ở đktc. Giá trị của m là
A. 21,40 B. 11,375
C. 29,43 D. 22,75
Lời giải
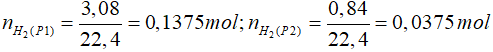
Phần 2 tác dụng với dung dịch NaOH dư tạo khí => Al còn dư sau phản ứng nhiệt nhôm
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
0,025 mol ← 0,0375 mol
=> nAldư = 0,025 mol
Phần 1 tác dụng với dung dịch H2SO4 loãng dư => Al và Fe phản ứng tạo khí
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
0,025 mol → 0,0375 mol
Fe + H2SO4 → FeSO4 + H2
0,1 mol ← 0,1 mol
Phản ứng nhiệt nhôm:
2Al + Fe2O3 → Al2O3 + 2Fe
0,1 ← 0,05 ← 0,1 mol
=> ∑nAlban đầu = nAldư + nAlphảnứng = 0,025 + 0,1 = 0,125 mol
=> mhh1 phần = mAl + mFe2O3= 0,125.27 + 0,05.160
= 11,375 gam => mhhban đầu = 11,375.2 = 22,75 gam
Đáp án: D
Bài 8: Hỗn hợp X gồm Al, Fe2O3 có khối lượng 21,67 gam. Tiến hành phản ứng nhiệt nhôm trong điều kiện không có không khí (giả sử chỉ xảy ra phản ứng khử Fe2O3 thành Fe). Hòa tan hỗn hợp chất rắn sau phản ứng bằng dung dịch NaOH dư thu được 2,016 lít khí H2 (đktc) và 12,4 gam chất rắn không tan. Hiệu suất của phản ứng nhiệt nhôm là
A. 45% B. 50%
C. 71,43% D. 75%
Lời giải
Fe2O3 + 2Al 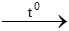 Al2O3 + 2Fe
Al2O3 + 2Fe
bđầu: y x
Pứ:  ← a →
← a →  → a
→ a
Sau pứ: (y - 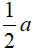 ) (x – a)
) (x – a) 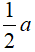 a
a
Do chất rắn sau phản ứng tác dụng với NaOH tạo khí nên dư Al
=> nH2 = 1,5.nAl + mFe2O3= 0,125.27 + 0,05.160(1)
mX = 160y + 27x = 21,67 (2)
mrắnkhôngtan = mFe2O3 + mFe = 160 (y-(3c)
ừ (1), (2) và (3), giải hệ ta có: x = 0,21 mol; y = 0,1 mol; a = 0,15 mol
Tính hiệu suất theo Fe2O3
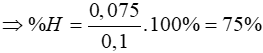
Đáp án: D
Bài 9: Khi nung hoàn toàn hỗn hợp A gồm x gam Al và y gam Fe2O3 thu được hỗn hợp B. Chia B thành hai phần bằng nhau: Phần 1 tan trong dung dịch NaOH dư, không có khí thoát ra và còn lại 4,4 gam chất rắn không tan. Phần 2 trong dung dịch H2SO4 loãng dư thu được 1,12 lít khí (đktc). Giá trị của y là
A. 5,6 B. 11,2
C. 16 D. 8
Lời giải
Phản ứng nhiệt nhôm: 2Al + Fe2O3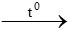 Al2O3 + 2Fe (1)
Al2O3 + 2Fe (1)
Phần 1 tác dụng với dung dịch NaOH dư không sinh ra khí => hỗn hợp B không có Al dư
=> hỗn hợp B gồm Al2O3, Fe và có thể có Fe2O3 dư
4,4 gam chất rắn không tan gồm Fe và Fe2O3
Phần 2: tác dụng với H2SO4 loãng dư => chỉ có Fe phản ứng sinh ra khí
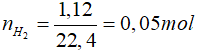
Fe + H2SO4 → FeSO4 + H2
0,05 mol ← 0,05 mol
⇒ mFe2O3 = 4,4 - mFe = 4,4 - 0,05.56 = 1,6 gam
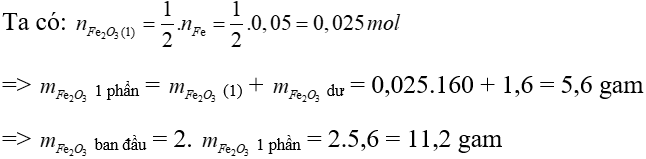
Đáp án: B
..............................................................................
..............................................................................
Thi online KHTN 9 KNTTThi online KHTN 9 CDThi online KHTN 9 CTST
Xem thêm bộ câu hỏi trắc nghiệm Hóa học lớp 9 chọn lọc, có đáp án mới nhất hay khác:
- Bài tập về Sắt lớp 9 (có lời giải)
- Bài tập về Hợp kim sắt: Gang, thép lớp 9 (có lời giải)
- Bài tập về Sự ăn mòn kim loại và bảo vệ kim loại không bị ăn mòn lớp 9 (có lời giải)
- Bài tập về Tính chất của phi kim lớp 9 (có lời giải)
- Bài tập về Clo lớp 9 (có lời giải)
- Bài tập về Cacbon lớp 9 (có lời giải)
Xem thêm các loạt bài Để học tốt Hóa học 9 hay khác:
- Giải bài tập Hóa học 9
- Giải sách bài tập Hóa 9
- Đề thi Hóa học 9
- Wiki 200 Tính chất hóa học
- Wiki 3000 Phản ứng hóa học quan trọng
Tủ sách VIETJACK luyện thi vào 10 cho 2k11 (2026):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài Chuyên đề: Lý thuyết - Bài tập Hóa học lớp 9 có đáp án được biên soạn bám sát nội dung chương trình sgk Hóa học 9.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 9 Global Success
- Giải sgk Tiếng Anh 9 Smart World
- Giải sgk Tiếng Anh 9 Friends plus
- Lớp 9 Kết nối tri thức
- Soạn văn 9 (hay nhất) - KNTT
- Soạn văn 9 (ngắn nhất) - KNTT
- Giải sgk Toán 9 - KNTT
- Giải sgk Khoa học tự nhiên 9 - KNTT
- Giải sgk Lịch Sử 9 - KNTT
- Giải sgk Địa Lí 9 - KNTT
- Giải sgk Giáo dục công dân 9 - KNTT
- Giải sgk Tin học 9 - KNTT
- Giải sgk Công nghệ 9 - KNTT
- Giải sgk Hoạt động trải nghiệm 9 - KNTT
- Giải sgk Âm nhạc 9 - KNTT
- Giải sgk Mĩ thuật 9 - KNTT
- Lớp 9 Chân trời sáng tạo
- Soạn văn 9 (hay nhất) - CTST
- Soạn văn 9 (ngắn nhất) - CTST
- Giải sgk Toán 9 - CTST
- Giải sgk Khoa học tự nhiên 9 - CTST
- Giải sgk Lịch Sử 9 - CTST
- Giải sgk Địa Lí 9 - CTST
- Giải sgk Giáo dục công dân 9 - CTST
- Giải sgk Tin học 9 - CTST
- Giải sgk Công nghệ 9 - CTST
- Giải sgk Hoạt động trải nghiệm 9 - CTST
- Giải sgk Âm nhạc 9 - CTST
- Giải sgk Mĩ thuật 9 - CTST
- Lớp 9 Cánh diều
- Soạn văn 9 Cánh diều (hay nhất)
- Soạn văn 9 Cánh diều (ngắn nhất)
- Giải sgk Toán 9 - Cánh diều
- Giải sgk Khoa học tự nhiên 9 - Cánh diều
- Giải sgk Lịch Sử 9 - Cánh diều
- Giải sgk Địa Lí 9 - Cánh diều
- Giải sgk Giáo dục công dân 9 - Cánh diều
- Giải sgk Tin học 9 - Cánh diều
- Giải sgk Công nghệ 9 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 9 - Cánh diều
- Giải sgk Âm nhạc 9 - Cánh diều
- Giải sgk Mĩ thuật 9 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

