Phần mềm Yenka | Hướng dẫn cách cài đặt và sử dụng phần mềm Yenka
Phần mềm Yenka | Hướng dẫn cách cài đặt và sử dụng phần mềm Yenka
Yenka là tập hợp các phòng thí nghiệm ảo, trong đó có thí nghiệm Hóa học với các hóa chất và dụng cụ phổ biến, để thực hiện các thí nghiệm vô cơ và điện hóa. Yenka mô phỏng các thí nghiệm ảo dễ dàng, nhanh chóng và hiệu quả. Có thể sử dụng Yenka để tiến hành thí nghiệm với một số chất độc hại hay không an toàn. Dưới đây là Hướng dẫn cài đặt và sử dụng phần mềm Yenka, mời các bạn tham khảo nhé!
1. Cài đặt phần mềm Yenka
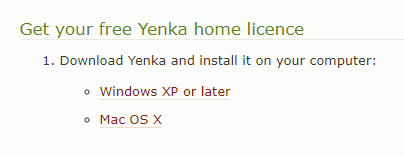
Truy cập trang chủ của nhà cung cấp theo đường dẫn: https://www.yenka.com chọn thẻ Use Yenka → Use Yenka free at home → … for student, chọn phiên bản sau đó tải phần mềm.
Sau khi tải phần mềm tiếp tục cài đặt theo hướng dẫn.
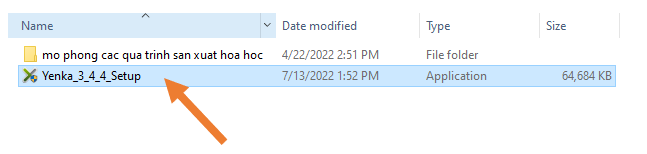
Bước 1: Sau khi tải xong bạn click đúp vào file Yenka
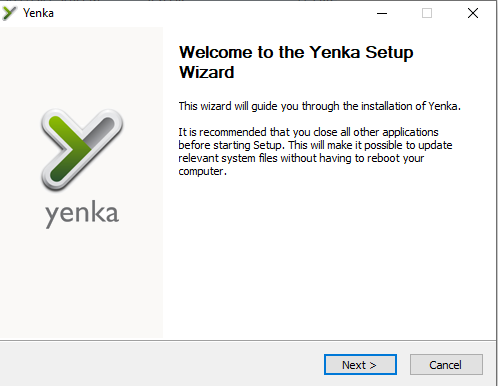
Bước 2: Sau khi cửa sổ Welcom xuất hiện bạn click chọn Next để tiếp tục
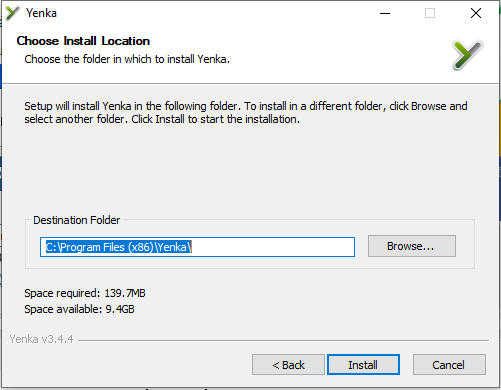
Bước 3: Tại đây bạn có thể thay đổi thư mục cài đặt của Yenka, mặc định sẽ được cài đặt trên ổ C (ổ cài Windows) bạn có thể thay đổi bằng cách click Browse … Sau đó click chọn Install để bắt đầu việc cài đặt.
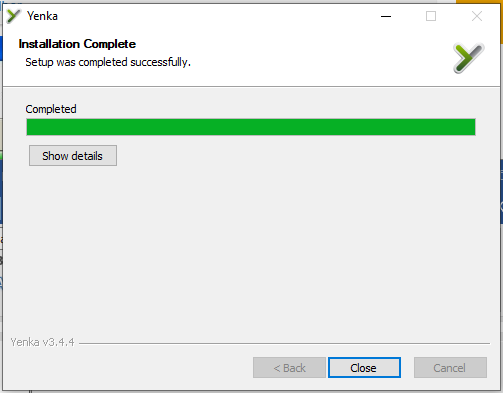
Bước 4: Quá trình cài đặt sẽ mất một khoảng thời gian nhất định, sau khi hiện thông báo Comlete thì bạn click chọn Close để đóng cửa sổ lại
Bước 5: Kết thúc bạn sẽ thấy biểu tượng của Yenka ngoài màn hình Desktop
2. Sử dụng phần mềm Yenka bản miễn phí
Bước 1: Download và cài đặt Yenka vào máy tính của bạn.
Bước 2: Khởi động Yenka bằng cách click đúp chuột trái vào biểu tượng Yenka trên màn hình.
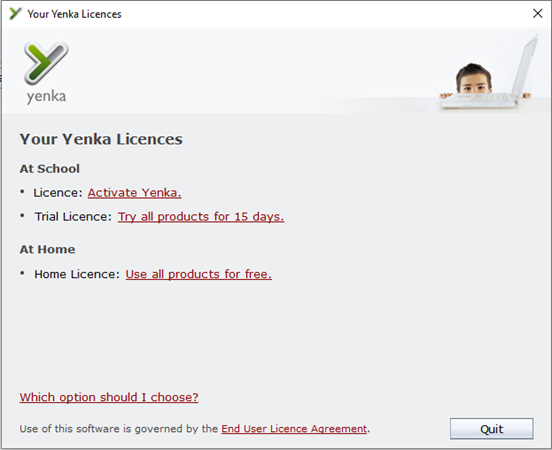
Bước 3: Trong cửa sổ Your Yenka licences, bạn click vào Use all products for free dưới mục At home.
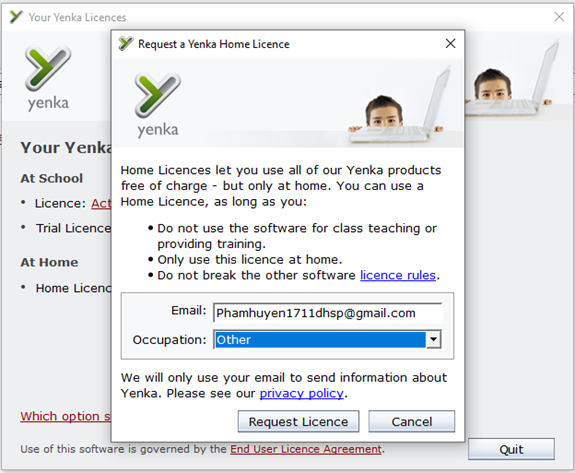
Bước 4: Đăng nhập tài khoản email và nghề nghiệp (Occupation), bạn chỉ cần đăng nhập email một lần duy nhất cho các lần sử dụng tiếp theo.
Bước 5: Nhấn Request Licence.
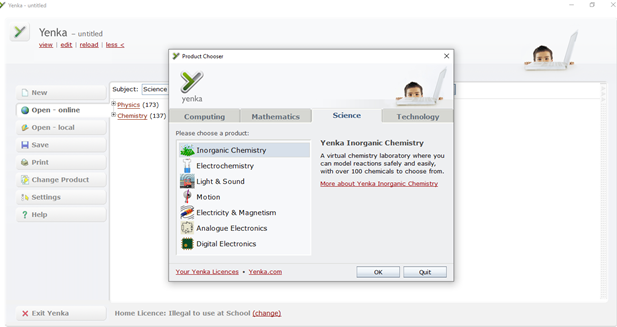
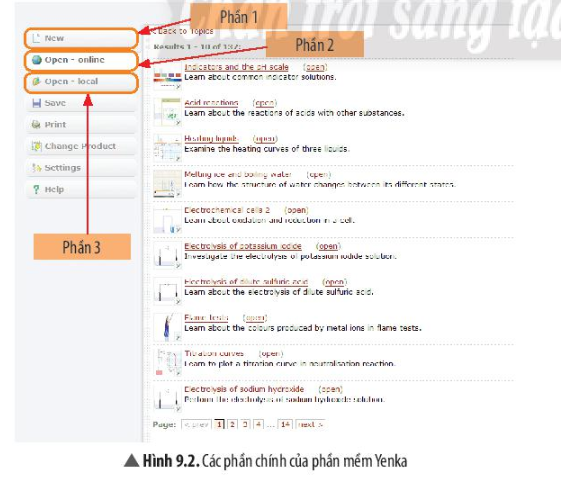
Màn hình làm việc của phầm mềm Yenka
Phần 1: New: Sử dụng hóa chất, thiết bị và dụng cụ để tự thiết kế thí nghiệm.
Phần 2: Open – online: Kho các bài thí nghiệm mở trực tuyến.
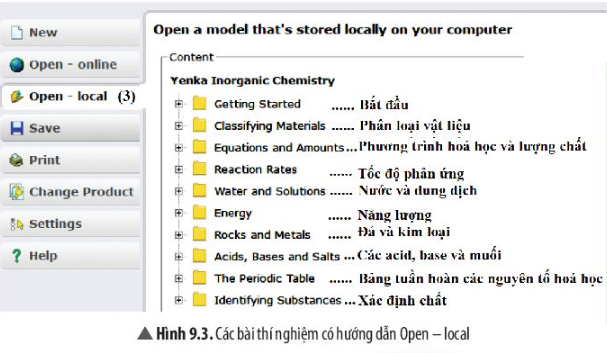
Phần 3: Open – local: Kho các bài thí nghiệm đã được chuẩn bị sẵn có hướng dẫn.
Kho các bài thí nghiệm có hướng dẫn Open – local chứa các thí nghiệm được sắp xếp theo các chủ đề thứ tự như sau:
Dưới đây là một số ví dụ sử dụng phần mềm giúp người dùng dễ hình dung.
3. Một số ví dụ minh họa
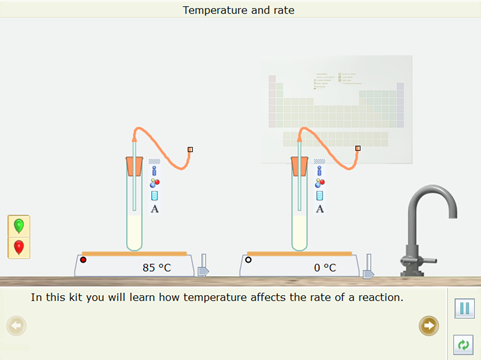
Ví dụ 1: Sử dụng thể Open – local của phần mềm Yenka, thực hiện thí nghiệm ảnh hưởng của nhiệt độ lên tốc độ phản ứng “Temperature and rate”. Phân tích là lí giải kết quả của thí nghiệm.
Hướng dẫn:
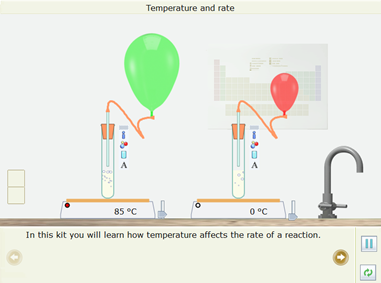
Bước 1: Nhấp chuột vào thể Open – local, chọn Reaction → Temperature and rate. Mô phỏng đã được thiết kế xuất hiện ở màn hình.
Bước 2: Nhấp chuột vào Next page để thực hiện theo hướng dẫn.
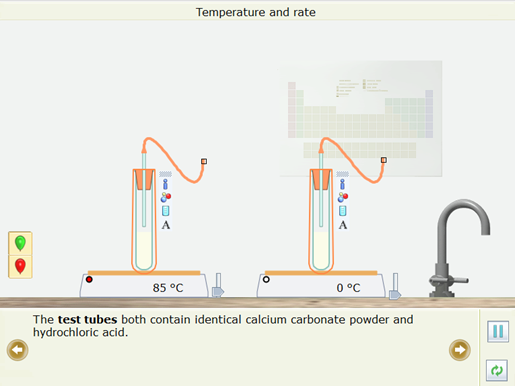
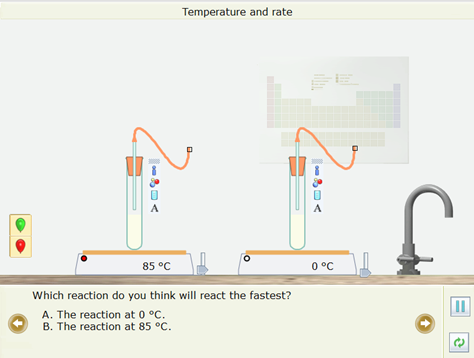
- Cả hai ống nghiệm đều chứa bột calcium carbonate và hydrochloric giống hệt nhau
- Em hãy dự đoán xem phản ứng ở ống nghiệm nào nhanh nhất?
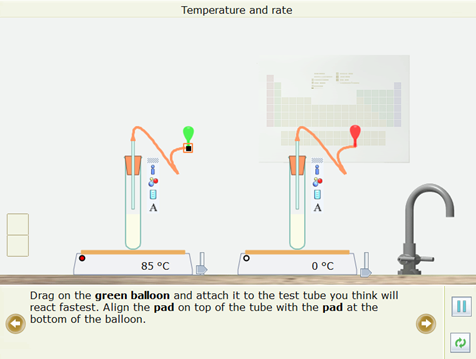
- Kéo quả bóng bay màu xanh lá cây lên và gắn nó vào ống nghiệm em cho là sẽ phản ứng nhanh nhất. Căn chỉnh miếng đệm trên đầu ống với miếng đệm ở đáy của quả bóng bay. Tương tự gắn quả bóng màu đỏ vào ống nghiệm mà em cho rằng sẽ phản ứng chậm nhất.
- Nhấp chuột vào nút Play/Pause để thực hiện thí nghiệm.
Bước 3: Ghi lại kết quả thí nghiệm và nhận xét
- Kết quả: Quả bóng ở ống nghiệm được đun nóng đến 85oC to lên nhanh hơn và vỡ trước.
- Nhận xét: Phương trình hóa học của phản ứng:
CaCO3(s) + 2HCl(aq) → CaCl2(aq) + CO2(g) + H2O(l)
Quả bóng ở ống nghiệm được đun nóng đến 85oC to lên nhanh hơn. Chứng tỏ nhiệt độ càng cao thì tốc độ phản ứng càng lớn.
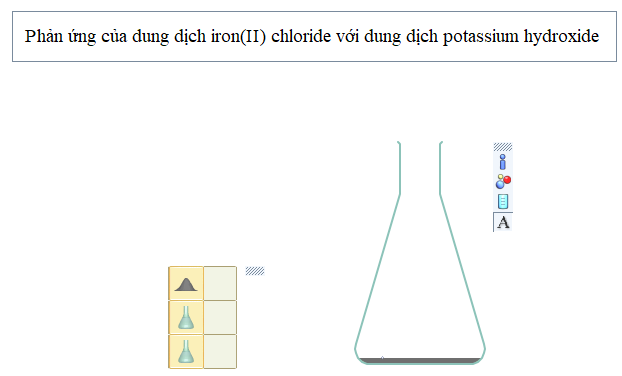
Ví dụ 2: Hãy thiết kế thí nghiệm (thẻ New): Phản ứng của dung dịch iron(II) chloride 1M (FeCl2) với dung dịch potassium hydroxide 1 M (KOH).
a) Ghi rõ các bước chuẩn bị hóa chất, dụng cụ, cách tiến hành thí nghiệm.
b) Nêu hiện tượng xảy ra và giải thích.
Hướng dẫn:
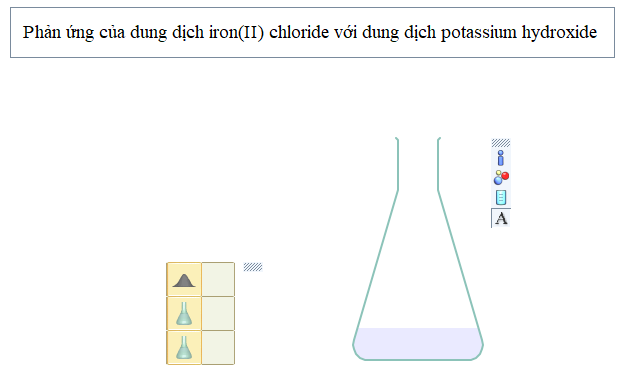
Bước 1: Nhấp chuột vào thẻ New, chọn Presentation → rồi kéo ra màn hình làm việc, gõ tên thí nghiệm “Phản ứng của dung dịch iron(II) chloride với dung dịch potassium hydroxide”. Sau đó chọn
(khay để lấy hóa chất, dụng cụ)
Bước 2: Lấy hóa chất
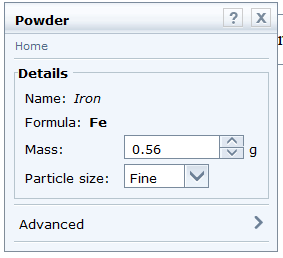
- Chọn Fe: Nhấp chuột vào thẻ Chemicals → Metal → Iron. Kéo thả vào khay.
Nhấp vào thông số khối lượng, điều chỉnh khối lượng Fe về 0,56 gam.
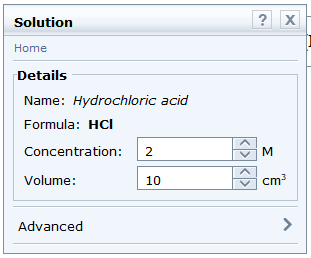
- Chọn hydrochloric acid: Chemicals → Acids → hydrochloric acid. Kéo thả vào khay. Nhấp vào các thông số về nồng độ và thể tích để điều chỉnh cho phù hợp với thí nghiệm. Chọn nồng độ 2 M và thể tích 10 cm3
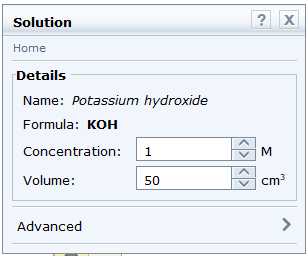
- Chọn dung dịch potassium hydroxide: Chemicals → Alkalis → Potassium hydroxide. Thông số về nồng độ là 1M phù hợp với thí nghiệm nên không cần điều chỉnh.
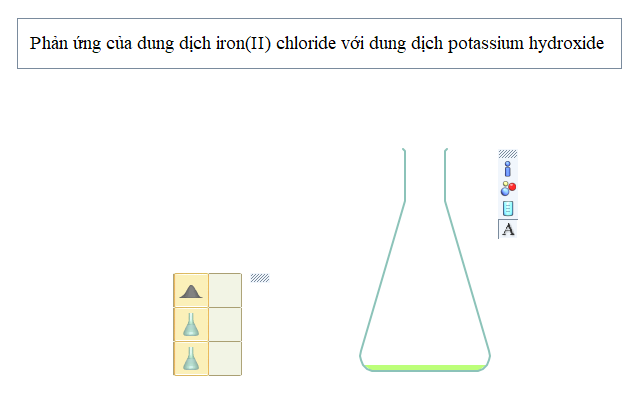
Bước 3: Lấy dụng cụ
- Chọn bình tam giác: Nhấp chuột vào thẻ Glassware → Standard → Erlenmeyer flask
Bước 4: Nhấp nút Play/Pause 
Nhấn nút Play/Pause trên thanh công cụ để thí nghiệm bắt đầu diễn ra, quan sát hiện tượng xảy ra. Muốn phản ứng xảy ra nhanh hay chậm, nhấp chuột vào nút Simulation Speed
Nhấp nút Play/Pause 
Nhấn nút Play/Pause trên thanh công cụ để thí nghiệm bắt đầu diễn ra, quan sát hiện tượng xảy ra. Muốn phản ứng xảy ra nhanh hay chậm, nhấp chuột vào nút Simulation Speed
Bước 5: Sau khi các chất phản ứng với nhau, nhấn chuột vào các icon bên phải của dụng cụ để biết các thông tin:
Bước 6: Quan sát – Giải thích thí nghiệm
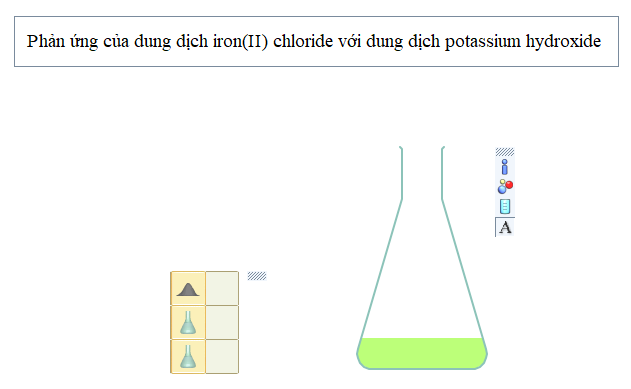
Hiện tượng:
- Đầu tiên iron (Fe) tan trong HCl để được dung dịch màu xanh, có khí thoát ra (coi thể tích dung dịch thay đổi không đáng kể sau phản ứng);
- Thêm tiếp dung dịch potassium hydroxide vào bình phản ứng thu được kết tủa màu trắng hơi xanh;
Giải thích bằng phương trình hóa học:
Fe + 2HCl → FeCl2 + H2↑
FeCl2 + 2KOH → Fe(OH)2↓ + 2KCl
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)







 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

