Trọn bộ Công thức Hóa học lớp 12 Học kì 1, Học kì 2 quan trọng
Trọn bộ Công thức Hóa học lớp 12 Học kì 1, Học kì 2 quan trọng sẽ giúp học sinh nắm vững công thức, dễ dàng tổng kết lại kiến thức đã học từ đó có kế hoạch ôn tập hiệu quả để đạt kết quả cao trong các bài thi môn Hóa học 12.
Trọn bộ Công thức Hóa học lớp 12 Học kì 1, Học kì 2 quan trọng
Chương 1: ester – lipid
Chương 2: Cacbohiđrat
Chương 3: Amin, amino acid và protein
Chương 4: polymer và vật liệu polymer
Chương 5: Đại cương về kim loại
Chương 6: Kim loại kiềm, kim loại kiềm thổ, nhôm
Công thức tính nhanh số mol OH- hoặc số mol Al(OH)3 khi cho muối nhôm phản ứng với dung dịch kiềm
Công thức tính nhanh số mol H+ khi cho từ từ axit vào muối AlO2 (muối aluminat)
Chương 7: Sắt và một số kim loại quan trọng
Chương 1: ester – lipid
Công thức tính hiệu suất phản ứng ester hóa hay nhất
Phản ứng ester hóa là phản ứng thuận nghịch (xảy ra không hoàn toàn) nên thường đi kèm với hiệu suất phản ứng. Cách tính hiệu suất phản ứng ester hóa như thế nào? Bài viết dưới đây sẽ giúp các em học tốt dạng bài này.
1. Công thức tính hiệu suất phản ứng ester hóa
Phương trình phản ứng điều chế ester đơn chức từ carboxylic acid đơn chức và ancol đơn chức có dạng:
Trong đó: R là gốc hydrocarbon,
R’ là gốc hydrocarbon, R’ ≠ H
Theo phương trình:
- Tính hiệu suất theo chất phản ứng (tính theo chất có khả năng phản ứng hết)
- Tính hiệu suất theo chất sản phẩm:
- Áp dụng định luật bảo toàn khối lượng:
Ví dụ: Đun 12 gam acetic acid với 13,8 gam ethanol (có H2SO4 đặc làm xúc tác) đến khi phản ứng đạt tới trạng thái cân bằng, thu được 11 gam ester. Hiệu suất của phản ứng ester hóa là
A. 50%
B. 62,5%
C. 55%
D. 75%
Hướng dẫn giải
→ Đáp án B.
2. Bạn nên biết
Nếu đề bài cho hiệu suất (H%) yêu cầu tính m, V,...
Bước 1: Tính m, V,... (theo phương trình).
Bước 2: Áp dụng quy tắc phải nhân – trái chia
+ Nếu m, V của sản phẩm (bên phải) thì nhân kết quả ở bước 1 với hiệu suất.
+ Nếu m, V,... của chất phản ứng (bến trái) thì chia kết quả ở bước 1 cho hiệu suất.
3. Kiến thức mở rộng
Điều chế ester đa chức
Trong đó: R là gốc hydrocarbon,
R’ là gốc hydrocarbon, R’ ≠ H
n, m lần lượt là số chức axit, ancol.
Xét tỉ lệ:
Chú ý:
- Tính theo phương trình hóa học phải tính theo chất có khả năng phản ứng hết.
- Phản ứng ester hóa là phản ứng thuận nghịch (phản ứng không hoàn toàn).

4. Bài tập minh họa
Câu 1: Cho ethyl alcohol tác dụng với acetic acid thì thu được 22,0 gam ester, H = 25%. Khối lượng ancol phản ứng là
A. 26,0 gam. B. 46,0 gam. C. 92,0 gam. D. 11,5 gam
Hướng dẫn giải
→ Đáp án B
Câu 2: Cho 0,1 mol glycerol (C3H5(OH)3) phản ứng với 0,15 mol axit acrylic (CH2 = CHCOOH) có H2SO4 đặc với hiệu suất là 60% thu được m gam este X. Giá trị của m là:
A. 7,62g B. 15,24g C. 21,167g D. 9,62g
Hướng dẫn giải
→ axit có khả năng hết.
Theo phương trình n ester lý thuyết = n axit = 0,05 mol
→ n ester thực tế = 0,6.0,05 = 0,03 mol
→ m ester thực tế= 254.0,03 = 7,62 gam
→ Đáp án A
Công thức phản ứng xà phòng hóa ester hay nhất
Bài tập về phản ứng xà phòng hóa ester rất phổ biến trong các đề thi, đề kiểm tra. Nó cũng chiếm phần lớn số lượng so với các dạng bài tập khác và trải đều ở các mức độ (thông hiểu - vận dụng - vận dụng cao). Bài viết này sẽ giúp các em nắm rõ và thật tự tin khi giải các bài tập thủy phân ester.
1. Công thức giải bài toán phản ứng xà phòng hóa ester
a) Xà phòng hóa ester đơn chức, mạch hở
- Tổng quát:
→ nRCOOR’ p/ư = nNaOH p/ư = nRCOONa = nR’OH
- Một số công thức áp dụng:
+ Theo định luật bảo toàn khối lượng: mester + mNaOH = mmuối rắn + mR’OH
+ Theo định luật bảo toàn nguyên tố:
nOH (NaOH) = nOH (R’OH); nNa (NaOH) = nNa (RCOONa)
b) Xà phòng hóa ester đa chức
- ester tạo thành từ axit đơn chức và ancol đa chức (n chức): (RCOO)nR’
- ester tạo nên từ ancol và axit có 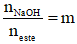
+ n-COO- = nNaOH
+ mester + mNaOH pư = mmuối rắn + mancol
c) Xà phòng hóa ester của phenol
Tổng quát:
→ Nếu phản ứng vừa đủ:
- Định luật bảo toàn khối lượng: mester + mNaOH pư = mmuối rắn + mH2O
- Hỗn hợp ester đơn chức có 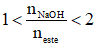
Ví dụ: Cho 0,1 mol một ester X tác dụng vừa đủ với dung dịch chứa 0,2 mol NaOH, thu được hỗn hợp hai muối của hai axit hữu cơ đều đơn chức và 6,2 g một ancol Y. Y là
A. propan-1,3-điol. B. butan-1-ol.
C. propan-1-ol hay propan-2-ol. D. ethylene glycol.
Hướng dẫn giải
Theo đề bài sau phản ứng thu được hỗn hợp hai muối của hai axit hữu cơ đều đơn chức và ancol; lại có 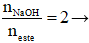
→ nacol = nester = 0,1 mol
→ Mancol =
→ ancol Y là C2H4(OH)2 etylenglicol
→ Đáp án D
2. Bạn nên biết:
- Cô cạn dung dịch sau phản ứng được chất rắn khan, chú ý đến lượng NaOH còn dư hay không.
mrắn khan = mmuối + mNaOH (nếu có)
3. Kiến thức mở rộng
ester tạo thành từ axit đa chức (n chức) và ancol đa chức (m chức):
nmuối = (số chức ancol).nester
nancol = (số chức axit).nester
n-COO- = nNaOH = (số chức ancol).(số chức axit).nester

4. Bài tập minh họa
Câu 1: Thuỷ phân hoàn toàn 0,2 mol một ester E cần dùng vừa đủ 100 gam dung dịch NaOH 24%, thu được một ancol và 43,6 gam hỗn hợp muối của hai carboxylic acid đơn chức. Hai axit đó là
A. HCOOH và CH3COOH
B. CH3COOH và C2H5COOH
C. C2H5COOH và C3H7COOH
D. C3H7COOH và C4H9COOH
Hướng dẫn giải
nNaOH = 0,6 mol
Kết hợp đề bài → ester 3 chức tạo bởi carboxylic acid đơn chức và ancol 3 chức
→ n muối = n NaOH = 0,6 mol
Gọi công thức chung của hai muối là
→ 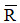
→ 2 muối HCOONa và CH3COONa thỏa mãn
→ Đáp án A
Câu 2: Cho 0,1 mol phenyl axetat tác dụng hết với 300 ml dung dịch NaOH 1M. Kết thúc phản ứng, cô cạn dung dịch thì khối lượng chất rắn khan thu được là
A. 16,2 gam.
B. 22,0 gam.
C. 19,8 gam.
D. 23,8 gam.
Hướng dẫn giải
nNaOH = 0,3 mol
Áp dụng định luật bảo toàn khối lượng:
mester + mNaOH = m rắn + mH2O
136.0,1 + 40.0,3 = m rắn + 18.0,1
→ m rắn = 23,8 gam
→ Đáp án D
Công thức phản ứng xà phòng hóa chất béo hay nhất
Bài tập về phản ứng thủy phân chất béo trong môi trường kiềm (phản ứng xà phòng hóa) là dạng bài tập trọng tâm về chất béo, tuy nhiên nhiều em học sinh vẫn còn lúng túng khi gặp phải dạng bài này. Bài viết dưới đây sẽ giúp các em có cái nhìn khái quát hơn về dạng bài tập, đồng thời cung cấp các phương pháp giải nhanh để các em có thể giải quyết dạng bài tập này một cách dễ dàng nhất.
1. Công thức bài toán phản ứng xà phòng hóa chất béo
Phương trình phản ứng thủy phân chất béo trong môi trường kiềm (phản ứng xà phòng hóa)
- Theo phương trình ta có:
- Áp dụng định luật bảo toàn khối lượng:
m chất béo + mNaOH = mmuối + mglycerol
Lưu ý: Mglycerol = 92 (g/mol)
Ví dụ: Xà phòng hóa hoàn toàn m gam tristearin cần vừa đủ 300 ml dung dịch NaOH 0,2 M. Giá trị của m là
A. 17,68. B. 17,80. C. 53,40. D. 53,04
Hướng dẫn giải
nNaOH = 0,3.0,2 = 0,06 mol
Tristearin: (C17H35COO)3C3H5 (M = 890 g/mol)
→ m tristearin = 890.0,02 = 17,8 gam
→ Đáp án B

2. Bạn nên biết
Một số axit béo và triglixerit (chất béo) tương ứng với các axit béo đó:
|
Tên axit béo |
CTPT axit béo |
Tên triglixerit tương ứng |
CTPT triglixerit tương ứng |
Đặc điểm cấu tạo |
|
Axit panmitic |
C15H31COOH (M = 256) |
Tripanmitin |
(C15H31COO)3C3H5 (M = 806) |
No |
|
stearic acid |
C17H35COOH (M = 284) |
Tristearin |
(C17H35COO)3C3H5 (M = 890) |
No |
|
Axit oleic |
C17H33COOH (M = 282) |
Triolein |
(C17H33COO)3C3H5 (M = 884) |
Không no |
|
Axit linoleic |
C17H31COOH (M = 280) |
Trilinolein |
(C17H31COO)3C3H5 (M = 878) |
Không no |
4. Bài tập minh họa
Câu 1: Xà phòng hoá hoàn toàn 35,6 gam chất béo X cần vừa đủ dung dịch chứa 0,12 mol NaOH. Cô cạn dung dịch sau phản ứng, thu được m gam muối. Giá trị của m là
A. 38,08. B. 29,36. C. 36,72. D. 38,24.
Hướng dẫn giải
→ m glycerol = 0,04.92 = 3,68 gam
Áp dụng định luật bảo toàn khối lượng
m chất béo + m NaOH p/ư = m muối + m glycerol
35,6 + 0,12.40 = m + 3,68
→ m = 36,72 gam
→ Đáp án C
Câu 2: Xà phòng hóa hoàn toàn trieste X bằng dung dịch NaOH thì thu được 9,2 gam glycerol và 83,4 gam muối của axit béo B. Tên của B là
A. acetic acid. B. axit pamitic. C. axit oleic. D. stearic acid
Hướng dẫn giải
n glycerol = 0,1 mol
→ n xà phòng = 3.n glycerol = 3.0,1 = 0,3 mol
→ C15H31COONa
→ Axit béo B là axit panmitic C15H31COOH
→ Đáp án B
Công thức bài toán đốt cháy ester hay nhất
Bài toán đốt cháy ester là một trong các dạng bài tập đặc trưng của ester. Để làm tốt bài toán đốt cháy ester học sinh cần nắm vững mối liên hệ về sản phẩm cháy và sử dụng linh hoạt các định luật bảo toàn. Bài viết dưới đây tổng hợp tất cả các công thức giúp các em học sinh có thể làm tốt dạng bài tập này.
1. Các công thức giải bài toán đốt cháy ester
Gọi công thức phân tử tổng quát của este là CnH2n+2-2kO2x (n ≥ 2)
Trong đó: n là số nguyên tử cacbon trong phân tử este
k là độ bất bão hòa trong phân tử ester
x là số nhóm chức – COO -
Suy ra công thức este no, đơn chức, mạch hở là CnH2nO2 (n ≥ 2)
- Đối với ester no, đơn chức, mạch hở: CnH2nO2 (n ≥ 2)
- Đối với ester không no, đơn chức, một liên kết đôi C=C mạch hở: CnH2nO2
- Đối với ester no, hai chức, mạch hở:
- Đối với ester mạch hở bất kì, có độ bất bão hòa toàn phân tử là k (k gồm cả liên kết π ở nhóm chức và ở gốc hydrocarbon?
Ngoài ra, khi giải bài tập đốt cháy ester cần phối hợp các định luật bảo toàn khối lượng và bảo toàn nguyên tố:
- Bảo toàn nguyên tố:
- Bảo toàn khối lượng:
Ví dụ: X là hỗn hợp 2 ester đơn chức không no có 1 nối đôi trong gốc hydrocarbon, liên tiếp trong dãy đồng đẳng. Đốt cháy hoàn toàn m gam X được 1,4 mol CO2 và 1,1 mol H2O. Công thức phân tử 2 ester là
A. C4H6O2 và C5H8O2.
B. C4H4O2 và C5H6O2.
C. C3H4O2 và C4H6O2.
D. C3H2O2 và C4H4O2.
Hướng dẫn giải
ester đơn chức, không no có 1 nối đôi C=C cháy
Hai ester liên tiếp trong dãy đồng đẳng → C4H6O2 và C5H8O2
→ Đáp án A
2. Bạn nên biết
- Phản ứng đốt cháy ester no, đơn chức, mạch hở
- Phản ứng đốt cháy ester không no, đơn chức, một liên kết đôi C=C mạch hở hoặc ester no, hai chức, mạch hở
- Phản ứng tổng quát đốt cháy ester.

3. Kiến thức mở rộng
Xử lý sản phẩm cháy
Dẫn sản phẩm cháy đi qua dung dịch kiềm
+ Nếu Ba(OH)2/Ca(OH)2 dư:
4. Bài tập minh họa
Câu 1: Đốt cháy hoàn toàn một hỗn hợp gồm các ester đơn chức, no, mạch hở. Hấp thụ toàn bộ sản phẩm cháy vào bình đựng dung dịch Ca(OH)2 dư, thấy khối lượng bình tăng thêm 24,8 gam và thu được m gam kết tủa. Giá trị của m là
A. 40,0. B. 24,8. C. 20,0. D. 49,6
Hướng dẫn giải
Gọi công thức phân tử của ester no, đơn chức, mạch hở là CnH2nO2 (n ≥ 2)
→ Đáp án A
Câu 2: Đốt cháy hoàn toàn m gam hỗn hợp hai ester no, đơn chức, mạch hở cần dùng vừa đủ 15,12 lít khí O2 (đktc), sau phản ứng thu được 24,2 gam khí CO2. Giá trị của m là
A. 43,1
B. 12,5
C. 4,9
D. 21,5
Hướng dẫn giải
ester no, đơn chức, mạch hở
Áp dụng định luật bảo toàn khối lượng
→ m + 32. 0,675 = 44.0,55 + 18.0,55
→ m = 12,5 gam
→ Đáp án B
Công thức bài toán đốt cháy chất béo hay nhất
Bài toán đốt cháy chất béo là một trong những dạng toán đặc trưng của chất béo. Bài viết dưới đây đưa ra các công thức để giúp các em học sinh giải bài toán đốt cháy chất béo một cách nhanh chóng và chính xác, đem lại kết quả cao trong học tập.
1. Công thức giải bài toán đốt cháy chất béo
Gọi công thức phân tử chung của chất béo là: CnH2n+2-2kO6
Trong đó: k là độ bất bão hòa trong phân tử chất béo (gồm cả liên kết π ở nhóm chức và gốc hydrocarbon? (k ≥ 3)
- Công thức tính số mol chất béo:
- Áp dụng định luật bảo toàn khối lượng cho phản ứng cháy:
- Áp dụng định luật bảo toàn nguyên tố:
+) Số nguyên tử C trong hợp chất béo
Ví dụ: Hỗn hợp X gồm 2 triglixerit no. Đốt cháy hoàn toàn m gam X cần V lít oxi (đktc) thu được 34,272 lít CO2 (đktc) và 26,46 gam H2O. Giá trị của V là
A. 48,720.
B. 49,392.
C. 49,840.
D. 47,152.
Hướng dẫn giải:
Triglixerit no → Trong phân tử chứa 3 liên kết π
→ k = 3
Áp dụng công thức
nO (trong chất béo) = 6.nCB = 6.0,03 = 0,18 mol
Bảo toàn nguyên tố O
→ Đáp án A

2. Bạn nên biết:
- Công thức tính độ bất bão hòa k dựa vào CTPT của hợp chất hữu cơ chứa C, H, O
Trong đó:
C là số Cacbon có trong hợp chất hữu cơ
H là số H có trong hợp chất hữu cơ.
- Chất béo (hay còn gọi triglixerit hay triaxylglycerol): là trieste của glycerol với các axit béo.
- glycerol (hoặc glycerin): C3H5(OH)3 (M = 92 g/mol)
3. Kiến thức mở rộng
- Bài toán đốt cháy chất béo thường đi kèm với thủy phân chất béo hoặc cộng H2; Br2 vào gốc không no.
- Bài toán phụ cho chất béo không no phản ứng với dung dịch Br2 hoặc hiđro hóa (Ni, to)
- Bài toán phụ cho chất béo phản ứng với dung dịch NaOH (phản ứng xà phòng hóa).
4. Bài tập minh họa
Câu 1: Đốt cháy hoàn toàn 0,1 mol triglixetit ta thu được 250,8 gam CO2 và 90 gam H2O. Mặt khác 0,1 mol X phản ứng vừa đủ với V lít dung dịch Br2 1M. Giá trị của V là
A. 0,7 B. 0,3 C. 0,5 D. 0,4
Hướng dẫn giải:
Áp dụng công thức:
→ Có 8 liên kết π trong đó 3π trong nhóm chức -COO- và 5π trong C=C
→nBr2 = 5.nCB = 5.0,1 = 0,5 mol
→ Đáp án C.
Câu 2: Đốt cháy hoàn toàn 17,72g một chất béo cần 1,61 mol O2 thu được CO2 và 1,06 mol H2O. Mặt khác cho 26,58 gam chất béo này vào vừa đủ dung dịch NaOH thì thu được lượng muối là
A. 18,56g B. 27,42g C. 27,14g D. 18,28g
Hướng dẫn giải:
Áp dụng định luật bảo toàn khối lượng:
Ứng với 26,58 gam chất béo:
Áp dụng ĐLBTKL: m CB + m NaOH pư = m muối + m glycerol
→ 26,58 + 40.0,09 = m muối + 92. 0,03
→ m muối = 27,42 gam
→ Đáp án B
....................................
....................................
....................................
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)

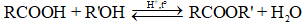
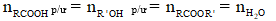
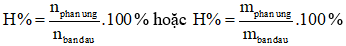
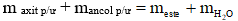
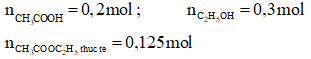
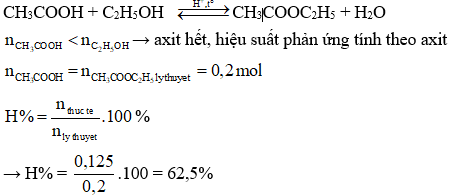
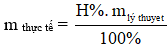
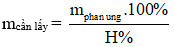
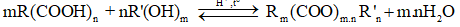

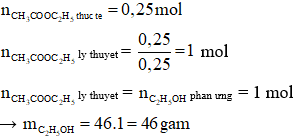
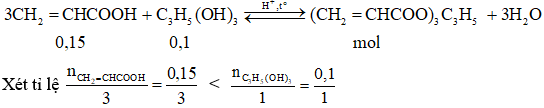
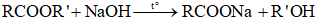
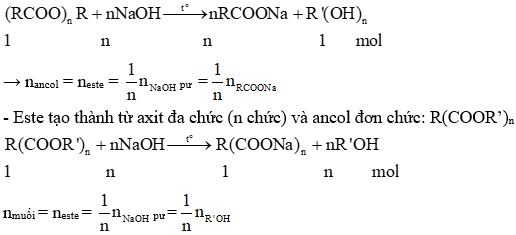
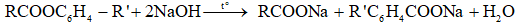
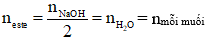
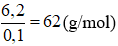
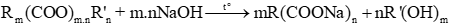
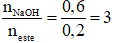
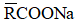
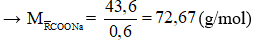
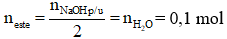
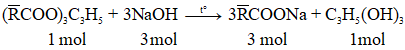
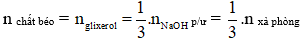
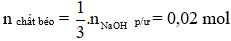
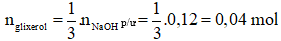
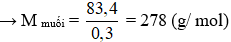
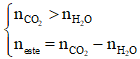
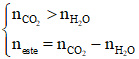
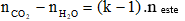
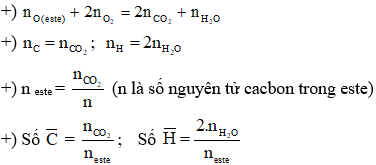
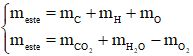
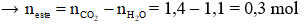
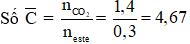
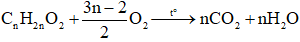
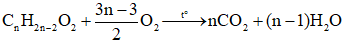
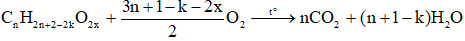
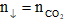
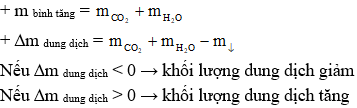
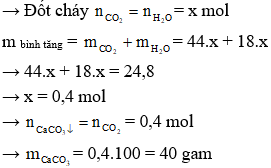
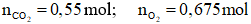
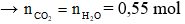
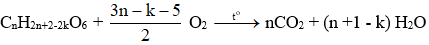
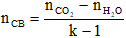
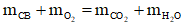
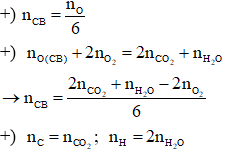
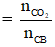

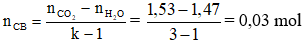
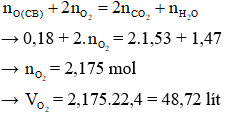
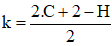

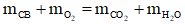
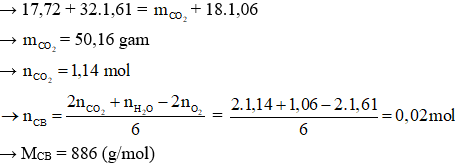
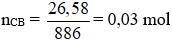



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

