Công thức tính nhanh số mol OH- hoặc số mol Al(OH)3 khi cho muối nhôm phản ứng với dung dịch kiềm (hay, chi tiết)
Bài viết Công thức tính nhanh số mol OH- hoặc số mol Al(OH)3 khi cho muối nhôm phản ứng với dung dịch kiềm hay nhất, chi tiết với bài tập minh họa có lời giải sẽ giúp học sinh nắm vững Công thức tính nhanh số mol OH- hoặc số mol Al(OH)3 khi cho muối nhôm phản ứng với dung dịch kiềm từ đó biết cách làm bài tập về tính nhanh số mol OH- hoặc số mol Al(OH)3 khi cho muối nhôm phản ứng với dung dịch kiềm.
Công thức tính nhanh số mol OH- hoặc số mol Al(OH)3 khi cho muối nhôm phản ứng với dung dịch kiềm (hay, chi tiết)
Một trong những bài toán hay và khó về hợp chất của nhôm đó là cho từ từ dung dịch kiềm vào dung dịch muối nhôm. Khi gặp bài toán này, nhiều bạn thường lúng túng khi viết phương trình và tính toán. Bài viết dưới đây, sẽ giúp các bạn làm chủ lý thuyết và nắm vững cách giải nhanh bài tập dạng này. Còn lý do gì mà bạn không tham khảo ngay và luôn.
1. Công thức tính nhanh số mol OH- hoặc số mol Al(OH)3 khi cho muối nhôm phản ứng với dung dịch kiềm
Khi cho từ từ a mol OH- vào dung dịch chứa b mol AL3+.
- Phương trình hóa học:
- Hiện tượng: Khi cho từ từ OH- vào dung dịch chứa muối AL3+ , ban đầu xuất hiện kết tủa dạng keo, khi cho dư OH- thì kết tủa tan dần.
- Khi đó tùy theo tỉ lệ số mol OH- : số mol AL3+ mà có kết tủa hoặc không có kết tủa hoặc vừa có kết tủa vừa có muối tan.
+ 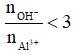
+ 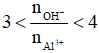
+ 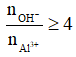
- Công thức giải nhanh:
+ Chỉ xảy ra phản ứng (1):
+ Xảy ra phản ứng (1) và (2):
2. Bạn nên biết
- Khi dẫn khí NH3 vào dung dịch AlCl3 có phản ứng hóa học sau:
AlCl3 + 3NH3 + 3H2O → Al(OH)3 + 3NH4Cl
Vì NH3 là bazơ yếu nên không thể hòa tan được hiđroxit Al(OH)3.
Hiện tượng: Có kết tủa keo trắng không tan.
3. Bài tập minh họa tính nhanh số mol OH- hoặc số mol Al(OH)3 khi cho muối nhôm phản ứng với dung dịch kiềm
Câu 1: Cho từ từ 0,7 mol NaOH vào dung dịch chứa 0,1 mol Al2(SO4)3. Số mol kết tủa thu được là:
A. 0,2
B. 0,15
C. 0,1
D. 0,05
Hướng dẫn giải
Cách 2:

Câu 2: Cho 200ml dung dịch AlCl3 1,5M tác dụng với V lít dung dịch NaOH 0,5M và lượng kết tủa thu được là 15,6 gam. Giá trị lớn nhất của V là:
A. 1,2
B. 1,8
C. 2,4
D. 2,0
Hướng dẫn giải
Ta có:
Thể tích NaOH lớn nhất khi kết tủa sinh ra cực đại sau đó bị NaOH hòa tan 1 phần còn 15,6 gam.
Phương trình hóa học:
Áp dụng công thức tính nhanh ta có:
Đáp án D
Câu 3: Cho 8,05 gam Na vào 200ml dung dịch AlCl3 0,5M. Sau phản ứng thu được chất kết tủa, nung kết tủa đến khối lượng không đổi thu được m gam chất rắn A. Giá trị của m là:
A. 7,8 gam
B. 1,02 gam
C. 2,55 gam
D. 2,04 gam
Hướng dẫn giải
Ta có: nNa = 0,35 mol, nAlCl3 = 0,1 mol
Phương trình hóa học:
2Na + 2H2O → 2NaOH + H2
Nhiệt phân kết tủa:
Đáp án C
Xem thêm các Công thức Hóa học lớp 12 quan trọng hay khác:
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)

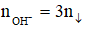
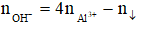
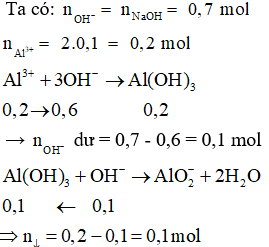
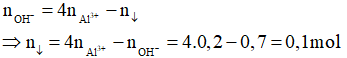
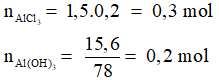
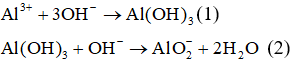
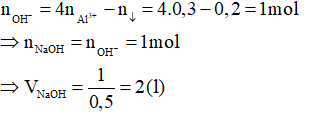
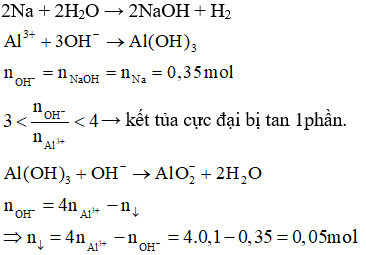
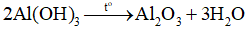
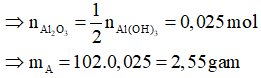



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

