Công thức tính lượng chất thu được ở điện cực (hay, chi tiết)
Bài viết Công thức tính lượng chất thu được ở điện cực hay nhất, chi tiết với bài tập minh họa có lời giải sẽ giúp học sinh nắm vững Công thức tính lượng chất thu được ở điện cực từ đó biết cách làm bài tập về tính lượng chất thu được ở điện cực.
Công thức tính lượng chất thu được ở điện cực (hay, chi tiết)
Bài tập điện phân là một trong các dạng bài tập thường gặp trong các đề thi. Đa số, các em thường lúng túng và sợ gặp các bài toán liên quan đến điện phân. Bài viết dưới đây, sẽ giúp các em nắm được cách tính khối lượng chất thu được ở điện cực áp dụng vào các bài điện phân cơ bản. Từ đó, làm tiền đề cho các em tiếp cận các bài điện phân nâng cao hơn.
1. Công thức tính lượng chất thu được ở điện cực
- Đối với các bài toán điện phân, khi tính lượng chất thu được ở điện cực sẽ sử dụng công thức định luật Faraday.
- Định luật Faraday: Khối lượng chất giải phóng ở mỗi điện cực tỉ lệ với điện lượng đi qua dung dịch và đương lượng của chất.
- Công thức định luật Faraday:
Trong đó:
m: Khối lượng chất giải phóng ở điện cực, tính bằng gam.
A: Khối lượng mol nguyên tử của chất thu được ở điện cực.
n: Số electron mà nguyên tử hoặc ion đã cho hoặc nhận.
I: Cường độ dòng điện, tính bằng ampe (A).
t: Thời gian điện phân, tính bằng giây (s).
F: Hằng số Faraday (96 500 culông/mol)
- Để làm tốt bài tập điện phân, các em có thể tính toán theo phương trình hoặc áp dụng các định luật bảo toàn nguyên tố và bảo toàn electron để giải bài tập.
2. Bạn nên biết
- Tại catot xảy ra sự khử còn anot xảy ra sự oxi hóa.
Ví dụ 1: Điện phân dung dịch CuSO4 với các điện cực trơ.
Sơ đồ điện phân:
Phương trình điện phân:
Ví dụ 2: Điện phân nóng chảy NaCl
Sơ đồ điện phân:
Phương trình điện phân:
- Những ion bị điện phân trong dung dịch:
* Catot
+ Ion kim loại từ K đến Al trong dãy điện hoá không tham gia điện phân mà nước sẽ bị điện phân sinh ra H2.
+ Những ion kim loại sau Al trong dãy điện hoá tham gia điện phân nhận electron tạo thành kim loại bám vào catot.
* Anot trơ
+ Những ion gốc axit không có oxi như CL-, Br-,...tham gia điện phân nhường electron tạo thành đơn chất.
+ Những ion gốc axit có oxi như 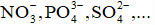

3. Mở rộng tính lượng chất thu được ở điện cực
Một số kiến thức mở rộng học sinh cần nắm được:
- Biểu thức liên hệ tính số mol electron trao đổi:
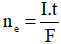
- Bảo toàn số mol electron: Tổng số mol electron catot nhận bằng tổng số electron anot nhường.
- Điều chế kim loại: nguyên tắc là khử ion kim loại thành kim loại.
+ Điện phân nóng chảy dùng điều chế các kim loại như: Na, K, Mg, Ca, Ba, Al.
+ Điện phân dung dịch dùng để điều chế các kim loại trung bình, yếu đứng sau Al trong dãy điện hóa.
4. Bài tập minh họa tính lượng chất thu được ở điện cực
Câu 1. Điện phân nóng chảy m gam NaCl, đến khi kết thúc quá trình điện phân thì ở anot thu được 2,24 lít khí (đktc). Giá trị của m là:
A. 11,7 gam
B. 5,85 gam
C. 23,4 gam
D. 8,775 gam
Hướng dẫn giải
Phương trình:
Đáp án A
Câu 2: Điện phân dung dịch CuSO4 bằng điện cực trơ với dòng điện có cường độ I = 0,5A trong thời gian 1930 giây thì khối lượng đồng và thể tích khí O2 sinh ra là
A. 0,64g và 0,112 lít
B. 0,32g và 0,056 lít
C. 0,96g và 0,168 lít
D. 1,28g và 0,224 lít
Hướng dẫn giải
Phương trình điện phân:
Áp dụng định luật Faraday ta có:
Đáp án B
Câu 3: Điện phân một dung dịch muối MCln với điện cực trơ. Khi ở catot thu được 16 gam kim loại M thì ở anot thu được 5,6 lít khí (đktc). Kim loại M là:
A. Mg
B. Fe
C. Cu
D. Ca
Hướng dẫn giải
Phương trình điện phân:
Đáp án C
Xem thêm các Công thức Hóa học lớp 12 quan trọng hay khác:
Công thức tính nhanh số mol OH- hoặc số mol Al(OH)3 khi cho muối nhôm phản ứng với dung dịch kiềm
Công thức tính nhanh số mol H+ khi cho từ từ axit vào muối AlO2 (muối aluminat)
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)

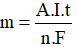
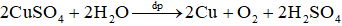
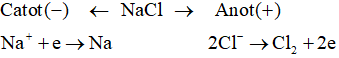
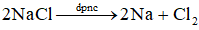
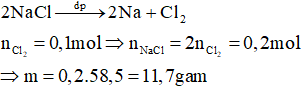
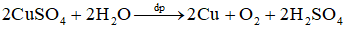
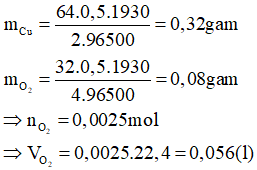



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

