Tổng hợp công thức Hóa học lớp 8, 9 (đầy đủ)
Tài liệu công thức Hóa học lớp 8, 9 mới nhất gồm định nghĩa, các công thức và bài tập ví dụ có lời giải chi tiết. Hi vọng bộ công thức Hóa học lớp 8 và lớp 9 này sẽ giúp học sinh nắm vững công thức từ đó từ đó biết cách làm các bài tập môn Hóa học lớp 8, 9.
Tổng hợp công thức Hóa học lớp 8, 9 (đầy đủ)
(199k) Xem khóa học KHTN 8 KNTTXem khóa học KHTN 8 CDXem khóa học KHTN 8 CTST
Lý thuyết trọng tâm Hóa học 8 (sách mới)
- Lý thuyết Hóa học 8 Kết nối tri thức
- Lý thuyết Hóa học 8 Chân trời sáng tạo
- Lý thuyết Hóa học 8 Cánh diều
Lý thuyết trọng tâm Hóa học 9 (sách mới)
- Lý thuyết Hóa học 9 Kết nối tri thức
- Lý thuyết Hóa học 9 Chân trời sáng tạo
- Lý thuyết Hóa học 9 Cánh diều
Lưu trữ: Công thức Hóa học 8 + 9 (sách cũ)

Công thức tính khối lượng chất tan (m hoặc mct; đơn vị: gam)
Công thức tính thành phần phần trăm về khối lượng các chất trong hỗn hợp
Công thức tính thành phần phần trăm về thể tích các chất trong hỗn hợp
Công thức tính khối lượng chất tham gia/sản phẩm khi có hiệu suất
Bảng hóa trị của nguyên tố, nhóm nguyên tố đầy đủ nhất
Hóa trị là con số biểu thị khả năng liên kết của nguyên tử (hay nhóm nguyên tử) nguyên tố này với nguyên tử (hay nhóm nguyên tử) nguyên tố khác.
Đây là kiến thức cơ bản và nền tảng nhất, là cơ sở để các em học tốt kiến thức hóa học ở các lớp trên.
Dưới đây là bảng hóa trị của các nguyên tố, nhóm nguyên tố xuất hiện thường xuyên trong chương trình hóa học lớp 8.
I/ Bảng nguyên tố hóa học và hóa trị của đơn chất
Số proton |
Tên nguyên tố |
Kí hiệu hóa học |
Nguyên tử khối |
Hóa trị |
1 |
Hiđro |
H |
1 |
I |
2 |
Heli |
He |
4 |
|
3 |
Liti |
Li |
7 |
I |
4 |
Beri |
Be |
9 |
II |
5 |
Bo |
B |
11 |
III |
6 |
Cacbon |
C |
12 |
IV,II |
7 |
Nitơ |
N |
14 |
III,II,IV,… |
8 |
Oxi |
O |
16 |
II |
9 |
Flo |
F |
19 |
I |
10 |
Neon |
Ne |
20 |
|
11 |
Natri |
Na |
23 |
I |
12 |
Magie |
Mg |
24 |
II |
13 |
Nhôm |
Al |
27 |
III |
14 |
Silic |
Si |
28 |
IV |
15 |
Photpho |
P |
31 |
III,V |
16 |
Lưu huỳnh |
S |
32 |
II,IV,VI |
17 |
Clo |
Cl |
35,5 |
I,… |
18 |
Agon |
Ar |
39,9 |
|
19 |
Kali |
K |
39 |
I |
20 |
Canxi |
Ca |
40 |
II |
. |
||||
. |
||||
. |
||||
24 |
Crom |
Cr |
52 |
II,III,… |
25 |
Mangan |
Mn |
55 |
II,IV,VII,… |
26 |
Sắt |
Fe |
56 |
II,III |
29 |
Đồng |
Cu |
64 |
I,II |
30 |
Kẽm |
Zn |
65 |
II |
35 |
Brom |
Br |
80 |
I… |
47 |
Bạc |
Ag |
108 |
I |
56 |
Bari |
Ba |
137 |
II |
80 |
Thủy ngân |
Hg |
201 |
I,II |
82 |
Chì |
Pb |
207 |
II,IV |
Lưu ý:
- Một số đơn chất phi kim có công thức phân tử như sau:
Khí oxi |
Khí hiđro |
Khí nitơ |
Khí flo |
Khí clo |
Brom |
Iot |
O2 |
H2 |
N2 |
F2 |
Cl2 |
Br2 |
I2 |
- Dãy hoạt động hóa học kim loại:
Khi Nào Cần May Áo Záp Sắt Nhớ Sang Phố Hỏi Cửa Hàng Áo Phi Âu
K Na Ca Mg Al Zn Fe Ni Sn Pb H Cu Hg Ag Pt Au

II: Hóa trị của nhóm nguyên tố
Tên nhóm |
Hóa trị |
|
Hiđroxit (OH), nitrate (NO3), Hiđro carbonate (HCO3), Đihiđro photphat (H2PO4) |
I |
|
Sunfit (SO3), Sunfat (SO4), carbonate (CO3), Hiđro photphat (HPO4) |
II |
Photphat (PO4) |
III |
III. Cách học thuộc hóa trị các nguyên tố đơn giản nhất
Một trong những cách học thuộc nhanh hóa trị các nguyên tố đó là học thuộc qua lời bài thơ. Dưới đây là một trong các bài ca hóa trị, các em tham khảo nhé!
Bài ca hóa trị
(sưu tầm)
Kali, Iot, Hiđro
Natri với Bạc, Clo một loài
Có hóa trị I bạn ơi
Nhớ ghi cho rõ kẻo rồi phân vân
Magie, Chì, Kẽm, Thủy ngân
Canxi, Đồng ấy cũng gần Bari
Cuối cùng thêm chú Oxi
Hóa trị II ấy có gì khó khăn
Bác Nhôm hóa trị III lần
Ghi sâu trí nhớ khi cần có ngay
Cacbon, Silic này đây
Là hóa trị IV không ngày nào quên
Sắt kia kể cũng quen tên
II, III lên xuống thật phiền lắm thay
Nitơ rắc rối nhất đời
I, II, III, IV khi thì là V
Lưu huỳnh lắm lúc chơi khăm
Lúc II, lúc VI khi nằm thứ IV
Photpho nói tới không dư
Nếu ai hỏi đến thì ừ rằng V
Bạn ơi cố gắng học chăm
Bài ca hóa trị suốt năm rất cần
Công thức tính số mol
Mol là gì? Cách tính số mol như thế nào? Là thắc mắc của rất nhiều em học sinh. Trong bài viết này, chúng ta sẽ trả lời các câu hỏi trên và vận dụng các bài tập liên quan đến tính số mol.
I/ Định nghĩa mol là gì?
Mol là lượng chất có chứa 6.1023 nguyên tử hoặc phân tử của chất đó.
Con số 6.1023 được gọi là số Avogađro và được kí hiệu là N.
Ví dụ:
- Một mol nguyên tử sắt có chứa 6.1023 nguyên tử sắt.
- Một mol phân tử nước có chứa 6.1023 phân tử nước.
Vậy số mol (n) được tính như thế nào? Dưới đây tổng hợp đầy đủ 7 công thức tính số mol thường gặp trong chương trình hóa học.
II / Các công thức tính số mol thường gặp
1. Công thức tính số mol khi biết khối lượng
n = 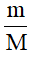
Trong đó:
+ m: khối lượng chất (đơn vị: gam).
+ M: khối lượng mol (đơn vị: g/mol).
Chú ý:
+ Công thức này áp dụng để tính số mol của tất cả các chất rắn, lỏng, khí …
+ Nếu đề bài cho tính số mol chất tan có trong dung dịch thì m là khối lượng chất tan có trong dung dịch.
2. Công thức tính số mol khí ở đktc khi biết thể tích
n = 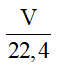
Trong đó:
+ V: thể tích khí ở đktc (đơn vị: lít).
+ Công thức này áp dụng cho tính số mol khí ở đktc.
3. Công thức tính số mol khi biết nồng độ mol và thể tích dung dịch
n = CM.Vdd
Trong đó:
CM: nồng độ dung dịch (đơn vị: mol/ lít)
Vdd: thể tích dung dịch (đơn vị: lít)
4. Công thức tính số mol khi biết nồng độ phần trăm và khối lượng dung dịch
n = 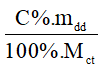
Trong đó:
C%: nồng độ phầm trăm (đơn vị: %)
mdd: khối lượng dung dịch (đơn vị: gam)
Mct: khối lượng mol chất tan (đơn vị: g/mol).
5. Công thức tính số mol khi biết nồng độ phần trăm, thể tích và khối lượng riêng của dung dịch
n = 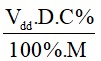
Trong đó:
Vdd: thể tích dung dịch (đơn vị: ml)
D: khối lượng riêng (g/ml)
C%: nồng độ phầm trăm (đơn vị: %)
M: khối lượng mol (đơn vị: g/mol).
6. Công thức tính số mol khí khi biết áp suất, thể tích và nhiệt độ xác định
n = 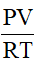
Trong đó:
P: áp suất (đơn vị: atm)
V: thể tích (đơn vị: lít)
R: hằng số (R = 0,082)
T: Nhiệt độ kenvin (T = oC + 273)
7. Công thức tính số mol theo định nghĩa
n = 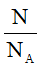
Trong đó:
N: số nguyên tử hoặc phân tử.
NA: số avogađro (NA = 6.1023)

III/ Bài tập có lời giải
Bài 1: Tính số mol của những lượng chất sau:
a) 4,6 gam Na;
b) 8,4 gam KOH;
c) 11,76 gam H3PO4;
d) 16 gam Fe2O3.
Hướng dẫn:
Áp dụng công thức: n = 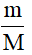
a) Số mol Na là: nNa = 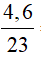 =0,2 mol
=0,2 mol
b) Số mol KOH là: nKOH = 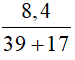 = 0,15 mol
= 0,15 mol
c) Số mol H3PO4 là: nH3PO4 = 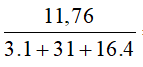 = 0,12 mol
= 0,12 mol
d) Số mol Fe2O3 là: nFe2O3 = 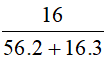 = 0,1 mol
= 0,1 mol
bài 2: Tính số mol của những chất khí sau, biết các khí đo ở điều kiện tiêu chuẩn
a) 2,24 lít khí C2H4
b) 3,36 lít khí CO2
c) 10,08 lít khí N2
Hướng dẫn:
Áp dụng công thức: n= 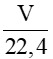
a) Số mol khí C2H4 là: nC2H4 = 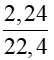 = 0,1 mol
= 0,1 mol
b) Số mol khí CO2 là: nCO2 = 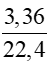 = 0,15 mol
= 0,15 mol
c) Số mol khí N2 là: nN2 = 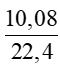 = 0,45 mol
= 0,45 mol
Bài 3: Hãy tính số mol của các chất sau:
a) Một dung dịch chứa MgCl2 1M có thể tích là 1,5 lít.
b) Một dung dịch có chứa NaCl 0,5M có thể tích là 5 lít .
Hướng dẫn:
Áp dụng công thức: n = CM . Vdd
a)Số mol của MgCl2 là: nMgCl2 = 1. 1,5= 1,5 mol
b) Số mol của NaCl là: nNaCl = 0,5 . 5= 2,5
Bài 4: Hãy tính số mol của NaOH có trong 200g dung dịch NaOH 15%.
Hướng dẫn :
Áp dụng công thức: n= 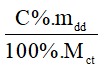
Số mol của NaOH là: nNaOH = 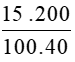 = 0,75 mol
= 0,75 mol
Bài 5: Cho 120 ml dung dịch KCl có nồng độ 20% (D=1,98 g/ml). Tính số mol của KCl trong dung dịch?
Hướng dẫn :
Áp dụng công thức: n = 
Số mol của KCl là:
nKCl = 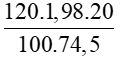 = 0,638 mol
= 0,638 mol
Bài 6: Tính số mol của 5 lít khí N2 ở 20, áp suất 1,5 atm?
Hướng dẫn :
Áp dụng công thức: n= 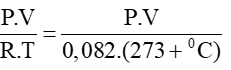
Số mol khí N2 là: nN2 = 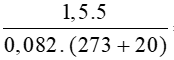 = 0,31 mol
= 0,31 mol
Bài 7:Tính số mol trong 9.1023 nguyên tử nhôm.
Hướng dẫn:
Áp dụng công thức: n = 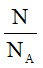
Số mol nhôm là: nAl = 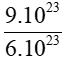 = 1,5 mol
= 1,5 mol
Công thức tính nồng độ phần trăm
I.Định nghĩa
- Nồng độ là khái niệm để biểu thị lượng hóa chất có trong một hỗn hợp, đa phần là dung dịch. Một số khái niệm nồng độ hay gặp là: nồng độ phần trăm, nồng độ mol,..
-Nồng độ phần trăm của dung dịch được kí hiệu là C% cho ta biết số gam chất tan có trong 100 gam dung dịch là bao nhiêu.
II.Công thức tính nồng độ phần trăm
1.Công thức tính nồng độ phần trăm khi biết khối lượng chất tan và khối lượng dung dịch
C% = 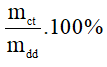
Trong đó:
mct: khối lượng chất tan (đơn vị: gam)
mdd: khối lượng dung dịch (đơn vị: gam)
2.Công thức tính nồng độ phần trăm khi biết nồng độ mol và khối lượng riêng
C% = 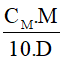
Trong đó:
CM: nồng độ mol (đơn vị: mol/ lít)
M: khối lượng mol (đơn vị: g/mol)
D: khối lượng riêng (đơn vị: g/ml)

III. Bài tập có lời giải
Bài 1: Tiến hành hòa tan hoàn toàn 3,9 gam Kali vào 36,2 gam nước thu được dung dịch B có nồng độ bao nhiêu?
Hướng dẫn:
Ta có: nK = 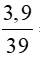 = 0,1 mol
= 0,1 mol
Phương trình hóa học
2K + 2H2O -> 2KOH + H2
0,1 0,1 0,05
Từ phương trình ta có:
nH2 = 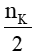 = 0,05 mol
= 0,05 mol
nKOH = nk = 0,1 mol
Áp dụng định luật bảo toàn khối lượng ta có:
mdd = mK + mH2O - mH2 = 3,9 + 36,2 - 0,05 . 2 = 40 gam
Nồng độ phần trăm của KOH là:
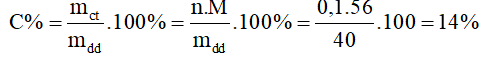
C% = 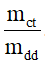 . 100%=
. 100%= 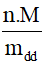 .100% =
.100% =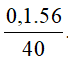 .100 = 14%
.100 = 14%
Bài 2: Cho dung dịch muối ăn NaCl có nồng độ mol là 1M, khối lượng riêng là 2,16 g/ml.Tính nồng độ phần trăm của muối ăn?
Hướng dẫn :
Áp dụng công thức: C% = 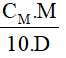
Nồng độ phần trăm của muối ăn là: C% = 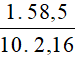 = 2,7 %
= 2,7 %
....................................
....................................
....................................
Trên đây là tóm lược một số nội dung có trong tổng hợp công thức Hóa học lớp 8 + 9, mời quí bạn đọc vào từng bài để xem đầy đủ, chi tiết!
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

