Công thức tính số mol (hay, chi tiết)
Bài viết Công thức tính số mol hay nhất, chi tiết với bài tập minh họa có lời giải sẽ giúp học sinh nắm vững Công thức tính số mol từ đó biết cách làm bài tập về tính số mol.
Công thức tính số mol (hay, chi tiết)
Công thức tính số mol (n; đơn vị: mol)
Mol là gì? Cách tính số mol như thế nào? Là thắc mắc của rất nhiều em học sinh. Trong bài viết này, chúng ta sẽ trả lời các câu hỏi trên và vận dụng các bài tập liên quan đến tính số mol.
I/ Định nghĩa mol là gì?
Mol là lượng chất có chứa 6.1023 nguyên tử hoặc phân tử của chất đó.
Con số 6.1023 được gọi là số Avogađro và được kí hiệu là N.
Ví dụ:
- Một mol nguyên tử sắt có chứa 6.1023 nguyên tử sắt.
- Một mol phân tử nước có chứa 6.1023 phân tử nước.
Vậy số mol (n) được tính như thế nào? Dưới đây tổng hợp đầy đủ 7 công thức tính số mol thường gặp trong chương trình hóa học.
II / Các công thức tính số mol thường gặp
1. Công thức tính số mol khi biết khối lượng
n = 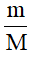
Trong đó:
+ m: khối lượng chất (đơn vị: gam).
+ M: khối lượng mol (đơn vị: g/mol).
Chú ý:
+ Công thức này áp dụng để tính số mol của tất cả các chất rắn, lỏng, khí …
+ Nếu đề bài cho tính số mol chất tan có trong dung dịch thì m là khối lượng chất tan có trong dung dịch.
2. Công thức tính số mol khí ở điều kiện chuẩn (đkc) khi biết thể tích
Trong đó: V (đơn vị lít) là thể tích chất khí đo ở điều kiện chuẩn (25oC, 1 atm)
3. Công thức tính số mol khi biết nồng độ mol và thể tích dung dịch
n = CM.Vdd
Trong đó:
CM: nồng độ dung dịch (đơn vị: mol/ lít)
Vdd: thể tích dung dịch (đơn vị: lít)
4. Công thức tính số mol khi biết nồng độ phần trăm và khối lượng dung dịch
n = 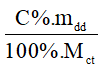
Trong đó:
C%: nồng độ phầm trăm (đơn vị: %)
mdd: khối lượng dung dịch (đơn vị: gam)
Mct: khối lượng mol chất tan (đơn vị: g/mol).
5. Công thức tính số mol khi biết nồng độ phần trăm, thể tích và khối lượng riêng của dung dịch
n = 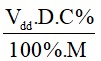
Trong đó:
Vdd: thể tích dung dịch (đơn vị: ml)
D: khối lượng riêng (g/ml)
C%: nồng độ phầm trăm (đơn vị: %)
M: khối lượng mol (đơn vị: g/mol).
6. Công thức tính số mol khí khi biết áp suất, thể tích và nhiệt độ xác định
n = 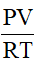
Trong đó:
P: áp suất (đơn vị: atm)
V: thể tích (đơn vị: lít)
R: hằng số (R = 0,082)
T: Nhiệt độ kenvin (T = oC + 273)
7. Công thức tính số mol theo định nghĩa
n = 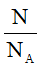
Trong đó:
N: số nguyên tử hoặc phân tử.
NA: số avogađro (NA = 6.1023)
III/ Bài tập có lời giải tính số mol
Bài 1: Tính số mol của những lượng chất sau:
a) 4,6 gam Na;
b) 8,4 gam KOH;
c) 11,76 gam H3PO4;
d) 16 gam Fe2O3.
Hướng dẫn:
Áp dụng công thức: n = 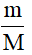
a) Số mol Na là: nNa = 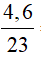 =0,2 mol
=0,2 mol
b) Số mol KOH là: nKOH = 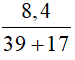 = 0,15 mol
= 0,15 mol
c) Số mol H3PO4 là: nH3PO4 = 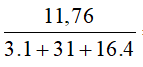 = 0,12 mol
= 0,12 mol
d) Số mol Fe2O3 là: nFe2O3 = 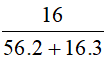 = 0,1 mol
= 0,1 mol
Bài 2: Tính số mol của những chất khí sau, biết các khí đo ở điều kiện chuẩn.
a) 12,395 lít khí C2H4
b) 3,7185 lít khí CO2
c) 19,832 lít khí N2
Hướng dẫn:
Áp dụng công thức:
a) Số mol khí C2H4 là:
b) Số mol khí CO2 là:
c) Số mol khí N2 là:
Bài 3: Hãy tính số mol của các chất sau:
a) Một dung dịch chứa MgCl2 1M có thể tích là 1,5 lít.
b) Một dung dịch có chứa NaCl 0,5M có thể tích là 5 lít .
Hướng dẫn:
Áp dụng công thức: n = CM . Vdd
a)Số mol của MgCl2 là: nMgCl2 = 1. 1,5= 1,5 mol
b) Số mol của NaCl là: nNaCl = 0,5 . 5= 2,5
Bài 4: Hãy tính số mol của NaOH có trong 200g dung dịch NaOH 15%.
Hướng dẫn :
Áp dụng công thức: n= 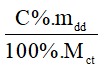
Số mol của NaOH là: nNaOH = 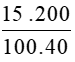 = 0,75 mol
= 0,75 mol
Bài 5: Cho 120 ml dung dịch KCl có nồng độ 20% (D=1,98 g/ml). Tính số mol của KCl trong dung dịch?
Hướng dẫn :
Áp dụng công thức: n = 
Số mol của KCl là:
nKCl = 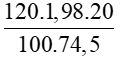 = 0,638 mol
= 0,638 mol
Bài 6: Tính số mol của 5 lít khí N2 ở 20oC, áp suất 1,5 atm?
Hướng dẫn :
Áp dụng công thức:
Số mol khí N2 là:
Bài 7:Tính số mol trong 9.1023 nguyên tử nhôm.
Hướng dẫn:
Áp dụng công thức: n = 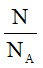
Số mol nhôm là: nAl = 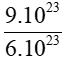 = 1,5 mol
= 1,5 mol
IV/ Bài tập thêm tính số mol
Câu 1: Số mol nguyên tử K có trong 1,5.1023 nguyên tử K là
A. 0,25 mol.
B. 0,35mol.
C. 0,45 mol.
D. 0,5 mol.
Câu 2: Cho 9.1023 phân tử O2 tương ứng với số mol là
A. 1,6 mol.
B. 1,5 mol.
C. 1,4 mol.
D. 1,3 mol.
Câu 3: Trong 0,8 mol HCl chứa số phân tử là
A. 3,8.1023.
B. 5,8.1023.
C. 4,8.1023.
D. 6,8.1023.
Câu 4: Số mol phân tử có trong 0,75.1023 phân tử MgSO4 là
A. 0,25 mol.
B. 0,5 mol.
C. 0,125 mol.
D. 0,75 mol.
Câu 5: Trong 0,4 mol nguyên tử S có chứa bao nhiêu nguyên tử S?
A. 1,2.1023.
B. 2,6.1023.
C. 2,4.1023.
D. 1,5.1023.
Câu 6: Số mol nguyên tử có trong 27.1023 nguyên tử Fe là
A. 1,6 mol.
B. 4,50 mol.
C. 5,25 mol.
D. 2,50 mol.
Câu 7: Trong 0,5 mol khí H2 có bao nhiêu nguyên tử H?
A. 4.1023.
B. 6.1023.
C. 8.1023.
D. 1.1024.
Câu 8: Trong 1,25 mol CO2 có bao nhiêu phân tử CO2?
A. 5,5.1023.
B. 6,5.1023.
C. 7,5.1023.
D. 8,5.1023.
Câu 9: Tính số mol nguyên tử Ag có trong 1,5.1023 nguyên tử Ag.
A. 0,05.1023.
B. 0,15.1023.
C. 0,25.1023.
D. 0,35.1023.
Câu 10: Tính số nguyên tử O có trong 0,55 mol phân tử O2.
A. 5,6.1023.
B. 6,6.1023.
C. 7,6.1023.
D. 8,6.1023.
Xem thêm Công thức Hóa học lớp 8, 9 đầy đủ, chọn lọc chi tiết khác:
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

