Trọn bộ Công thức Hóa học 10 quan trọng (cả năm)
Trọn bộ Công thức Hóa học 10 Học kì 1, Học kì 2 quan trọng chương trình sách mới Chân trời sáng tạo, Kết nối tri thức, Cánh diều sẽ giúp học sinh nắm vững công thức, dễ dàng tổng kết lại kiến thức đã học từ đó có kế hoạch ôn tập hiệu quả để đạt kết quả cao trong các bài thi môn Hóa học 10.
Trọn bộ Công thức Hóa học 10 quan trọng (cả năm)
(199k) Xem Khóa học Hóa 10 KNTTXem Khóa học Hóa 10 CDXem Khóa học Hóa 10 CTST
Công thức tính biến thiên enthalpy chuẩn theo năng lượng liên kết
Công thức tính biến thiên enthalpy theo nhiệt tạo thành chuẩn
Công thức tính tốc độ tức thời của phản ứng hay công thức định luật tác dụng khối lượng
(199k) Xem Khóa học Hóa 10 KNTTXem Khóa học Hóa 10 CDXem Khóa học Hóa 10 CTST
Lưu trữ: Tổng hợp công thức Hóa học 10 (sách cũ)
Chương 1: Nguyên tử
Chương 2: Bảng tuần hoàn các nguyên tố hóa học và Định luật tuần hoàn
Công thức oxit cao nhất, công thức hợp chất khí với hiđro các nguyên tố nhóm A
Công thức xác định hai nguyên tố thuộc hai chu kì liên tiếp trong cùng một nhóm A
Công thức xác định hai nguyên tố thuộc hai nhóm A liên tiếp trong cùng một chu kì
Chương 3: Liên kết hóa học
Chương 4: Phản ứng oxi hóa - khử
Chương 5: Nhóm Halogen
Chương 6: Oxi - Lưu huỳnh
Công thức tính nhanh số mol OH- khi cho SO2 với dung dịch kiềm
Công thức tính nhanh số mol OH- khi cho H2S tác dụng với dung dịch kiềm
Chương 7: Tốc độ phản ứng và cân bằng hóa học
Công thức xác định thành phần nguyên tử
Nguyên tử là hạt vô cùng nhỏ, trung hòa về điện và cấu tạo nên chất. Nguyên tử được cấu tạo nên từ ba hạt: electron, proton và neutron.
Vậy làm thế nào để xác định được đây là nguyên tử nào? Thành phần các hạt ra sao? Bài viết này sẽ giúp các em làm rõ vấn đề này.
1. Các công thức xác định thành phần nguyên tử
Để xác định được thành phần nguyên tử các nguyên tố, cần nhớ được các mối liên hệ sau:
+ Tổng số hạt của nguyên tử = số p + số e + số n
+ Tổng số hạt trong hạt nhân nguyên tử = số p + số n
+ Số hiệu nguyên tử: Z = số p =số e
Điện tích hạt nhân là Z+ -> Số đơn vị điện tích hạt nhân = Z
Số khối hạt nhân: A= Z + N = số p + số n
Trong đó:
+ n: neutron; N: tổng số hạt neutron.
+ p: proton
+ e: eletron
+ A là số khối hạt nhân
+ Z là số hiệu nguyên tử
Ví dụ: Tổng số hạt của của nguyên tử Na là 34, trong đó số hạt không mang điện là 12. Xác định số hạt proton và số khối của nguyên tử Na.
Hướng dẫn
Đặt số proton là p; số electron là n.
Ta có:
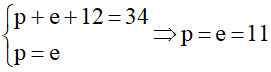
A = Z+ N= p + n =11+12=23
Vậy nguyên tử Na có 11 proton và số khối là 23.
2. Bạn nên biết
- Nguyên tử gồm 2 phần: lớp vỏ và hạt nhân
+ Lớp vỏ là các electron quay hỗn loạn quanh hạt nhân. Các electron (e) mang điện tích âm.
+ Hạt nhân gồm hạt proton mang điện tích dương và neutron không mang điện.
- Nguyên tử trung hòa về điện nên số hạt mang điện dương bằng số hạt mang điện tích âm.
3. Mở rộng
Đối với 82 nguyên tố đầu tiên trong bảng tuần hoàn ta có:
1≤ 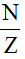 ≤ 1,5
≤ 1,5
4. Bài tập minh họa
Câu 1: Xác định số neutron trong nguyên tử oxi biết O có 8 proton và số khối là 16?
A.8 B. 16 C.6 D.18
Đáp án A
Số neutron là: N = A - Z = 16 – 8 = 8
Câu 2: Trong nguyên tử A, số hạt mang điện tích dương là 13, số hạt không mang điện là 14. Số hạt electron trong A là bao nhiêu?
A. 13 B. 15 C. 27 D.14
Đáp án A
Số hạt electron trong A là:
Số e = số p =13
Câu 3: Nguyên tử X có tổng số các loại hạt bằng 52, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 16 hạt. Số khối của X là:
A. 24 B. 27 C. 35 D. 40
Đáp án C
Đặt số proton, số neutron và số electron lần lượt là p, n và e
Ta có:
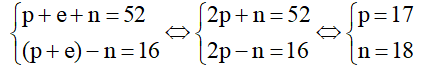
Số khối A = Z + N = p+n = 17+18 = 35
Công thức xác định thành phần các hạt trong ion
Nguyên tử luôn trung hòa về điện, nhưng khi nguyên tử nhường hay nhận thêm electron thì nó trở thành phần tử mang điện gọi là ion.
Vậy xác định thành phần các hạt trong ion bằng cách nào? Bài viết này sẽ giúp các em làm rõ vấn đề này.
1. Công thức xác định thành phần các hạt trong ion
- Sự hình thành cation: M → Mn+ + ne (với n là số electron do M nhường)
Tổng số electron của nguyên tử (phân tử) = tổng số electron của ion + n
-Sự hình thành anion: X + me → Xm- ( với m là số electron do X nhận)
Tổng số electron của nguyên tử (phân tử) = tổng số electron của ion - m
-Phương pháp: Dựa vào dữ kiện bài toán tìm mối liên hệ giữa số hạt p, số hạt e, số hạt n Tìm được ion
2. Bạn nên biết?
Trong các phản ứng hóa học, để đạt được cấu hình electron bền vững của khí hiếm:
+ Nguyên tử kim loại có khuynh hướng nhường electron lớp ngoài cùng cho nguyên tử các nguyên tố khác để trở thành phần tử mang điện dương gọi là ion dương hay cation.
M → Mn+ + ne
+ Nguyên tử phi kim có khuynh hướng nhận thêm electron của nguyên tử các nguyên tố khác để trở thành phần tử mang điện âm gọi là ion âm hay anion.
X + me → Xm-
3. Mở rộng
Ngoài việc phân chia ion thành ion âm (anion) và ion dương (cation) thì ion còn được phân loại như sau:
+ Ion đơn nguyên tử: Là các ion được tạo nên từ 1 nguyên tử, ví dụ: Li+; Cl- …
+ Ion đa nguyên tử: Là nhóm các nguyên tử mang điện tích dương hay âm, ví dụ:
NH+4 ; SO2-4 .....
4. Bài tập minh họa
Câu 1: Trong anion X- có tổng số hạt cơ bản là 53, số hạt mang điện chiếm 66,04%. Xác định nguyên tố X?
A. Flo
B. Clo
C. Brom
D. Iot
Hướng dẫn
Đặt số proton, số neutron và số electron của nguyên tử X lần lượt là p, n và e
Tổng số hạt cơ bản của anion X- là p + e + n + 1=53 hay 2p + n=52 ( do p = e).
Tổng số hạt mang điện của anion X- là p + e + 1 = 2p + 1
Ta có hệ:
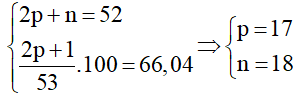
Vậy X là Clo
Đáp án B
Câu 2: Tổng số hạt mang điện âm trong ion AB43- là 50. Số hạt mang điện trong nguyên tử A nhiều hơn số hạt mang điện trong hạt nhân nguyên tử B là 22. Số hiệu nguyên tử A, B lần lượt là
A. 16 và 7
B.15 và 8
C. 7 và 16
D.8 và 15
Hướng dẫn giải:
Ion AB43- gồm 1 nguyên tử A + 4 nguyên tử B + 3 electron nên tổng số hạt mang điện âm là: ZA + 4ZB + 3 = 50 hay ZA + 4ZB = 47.
Hạt mang điện trong nguyên tử A nhiều hơn hạt mang điện trong hạt nhân nguyên tử B nên: 2ZA – ZB = 22.
Giải hệ ta được: ZA= 15 và ZB = 8.
Đáp án B
Câu 3: Một ion M3+ có tổng số hạt proton, neutron, electron là 79, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 19. Số khối của nguyên tử M là :
A. 56.
B. 55.
C. 65.
D. 64.
Hướng dẫn giải:
M3+ là do nguyên tử M bị mất đi 3 electron hình thành.
-> M có tổng số hạt proton, neutron, electron là : 79 + 3 = 82
Gọi số hạt proton, neutron, electron của M lần lượt là: p, n, e
-> p + n + e = 82 2p + n = 82 (I)
Mặt khác, trong M3+ số hạt mang điện nhiều hơn số hạt không mang điện là 19
-> p + e - 3 – n = 19 2p – n = 22 (II)
Từ (I) và (II) -> p = 26, n = 30.
ZM =26
-> Số khối của nguyên tử M= 26+30=56
Đáp án A
..........................
..........................
..........................
Xem thêm đề thi lớp 10 các môn học có đáp án hay khác:
Tài liệu giáo án lớp 10 các môn học chuẩn khác:
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

