Công thức tính nguyên tử khối trung bình của các nguyên tố hóa học (hay, chi tiết)
Bài viết Công thức tính nguyên tử khối trung bình của các nguyên tố hóa học hay nhất, chi tiết với bài tập minh họa có lời giải sẽ giúp học sinh nắm vững Công thức tính nguyên tử khối trung bình của các nguyên tố hóa học từ đó biết cách làm bài tập về tính nguyên tử khối trung bình của các nguyên tố hóa học.
- 1. Công thức tính nguyên tử khối trung bình của các nguyên tố hóa học
- 2. Bạn nên biết
- 3. Mở rộng tính nguyên tử khối trung bình của các nguyên tố hóa học
- 4. Bài tập minh họa tính nguyên tử khối trung bình của các nguyên tố hóa học
- 5. Bài tập tự luyện tính nguyên tử khối trung bình của các nguyên tố hóa học
Công thức tính nguyên tử khối trung bình của các nguyên tố hóa học (hay, chi tiết)
Nhiều nguyên tố hóa học tồn tại nhiều đồng vị trong tự nhiên nên nguyên tử khối của các nguyên tố này là nguyên tử khối trung bình của các đồng vị đó.
Vậy tính được nguyên tử khối trung bình của các nguyên tố hóa học như thế nào? Bài viết này sẽ giúp các em trả lời các câu hỏi trên.
1. Công thức tính nguyên tử khối trung bình của nguyên tố hóa học
- Giả sử một nguyên tố có 2 đồng vị X và Y. Kí hiệu X, Y đồng thời là nguyên tử khối của 2 đồng vị, tỉ lệ phần trăm số nguyên tử tương ứng là a và b. Khi đó: nguyên tử khối trung bình (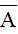 ) của nguyên tố này là:
) của nguyên tố này là:
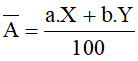
Chú ý: Một cách gần đúng, nguyên tử khối được lấy xấp xỉ bằng số khối.
2. Bạn nên biết
- Các đồng vị của cùng một nguyên tố là những nguyên tử có cùng số proton nhưng khác nhau về số neutron, do đó có số khối A khác nhau.
- Phần lớn các nguyên tố hóa học là hỗn hợp của nhiều đồng vị. Các đồng vị của cùng một nguyên tố hóa học có số neutron trong hạt nhân khác nhau, nên có một số tính chất vật lí khác nhau.
- Có các đồng vị bền và các đồng vị không bền. Hầu hết các đồng vị có số hiệu nguyên tử Z > 82 là không bền, chúng còn được gọi là các đồng vị phóng xạ.
3. Mở rộng tính nguyên tử khối trung bình của các nguyên tố hóa học
Xác định nguyên tử khối trung bình cho nguyên tố có n đồng vị:
Công thức: 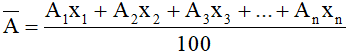
Trong đó: A1, A2, A3, .....An : là nguyên tử khối các đồng vị.
x1, x2, x3,.....xn : là thành phần % số nguyên tử của các đồng vị.

4. Bài tập minh họa tính nguyên tử khối trung bình của các nguyên tố hóa học
Câu 1: Cacbon có hai đồng vị là 12C chiếm 98,89% và 13C là 1,11%. Nguyên tử khối trung bình của nguyên tố cacbon là:
A. 12,0111
B. 12,0219
C. 12,0525
D. 12,5245
Hướng dẫn
Nguyên tử khối trung bình của nguyên tố cacbon là:
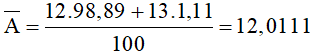
Đáp án A
Câu 2:Nitơ trong thiên nhiên là hỗn hợp gồm hai đồng vị là 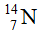 (99,63%) và
(99,63%) và 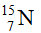 (0,37%). Nguyên tử khối trung bình của nitơ là:
(0,37%). Nguyên tử khối trung bình của nitơ là:
A. 14,7
B. 14,0
C. 14,4
D. 13,7
Hướng dẫn
Nguyên tử khối trung bình của nitơ là:
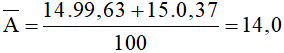
Đáp án B
Câu 3: Agon tách ra từ không khí là hỗn hợp ba đồng vị: 99,6% 40Ar; 0,063% 38Ar; 0,337% 36Ar. Nguyên tử khối trung bình của nguyên tố Agon là
A. 39,99
B. 37,99
C. 38,99
D. 35,99
Hướng dẫn:
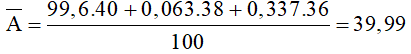
Đáp án A
Câu 4: Trong tự nhiên bromine có 2 đồng vị là 79Br và 81Br có nguyên tử khối trung bình là 79,92 amu. Tính % đồng vị 79Br trong tự nhiên.
Hướng dẫn giải
Gọi phần trăm đồng vị 79Br là a%.
⇒ Phần trăm của đồng vị 81Br là 100% - a%.
Nguyên tử khối trung bình của Br:
⇒ a = 54,5.
Câu 5: Trong tự nhiên nguyên tố chlorine có 2 đồng vị: ACl và BCl chiếm 75%. Nguyên tử khối trung bình của nguyên tố Cl là 35,5 amu. Biết rằng A – B = 2. Xác định 2 đồng vị của Cl.
Hướng dẫn giải
Theo giả thiết ta có:
Vậy hai đồng vị của chlorine là 37Cl và 35Cl.
5. Bài tập tự luyện tính nguyên tử khối trung bình của các nguyên tố hóa học
Câu 1: Nguyên tố bạc có 2 đồng vị trong tự nhiên là 107Ag chiếm 51,839% số nguyên tử. Tính số khối của đồng vị còn lại biết trong AgCl, bạc chiếm 75,254% về khối lượng. Cho MCl = 35,5.
A. 103 amu.
B. 104 amu.
C. 105 amu.
D. 106 amu.
Câu 2: Trong tự nhiên có hai đồng vị bền: 37Cl chiếm 24,23% tổng số nguyên tử, còn lại là 35Cl. Thành phần % theo khối lượng của 37Cl trong HClO4 là
A. 8,92.
B. 9,14.
C. 9,83.
D. 10,41.
Câu 3: Trong tự nhiên đồng có 2 đồng vị là và , trong đó đồng vị chiếm 27% về số nguyên tử. Xác định phần trăm khối lượng của trong phân tử Cu2O biết rằng nguyên tử khối của O bằng 16.
Câu 4: Trong tự nhiên Cu có hai đồng vị là chiếm 73% và . Tính nguyên tử khối trung bình của nguyên tố Cu.
Câu 5: Trong tự nhiên chlorine có 2 đồng vị là 35Cl và 37Cl. Nguyên tử khối trung bình của chlorine là 35,5. Thành phần % khối lượng của 37Cl trong KClO3 là (Cho nguyên tử khối của K và O lần lượt là 39 và 16).
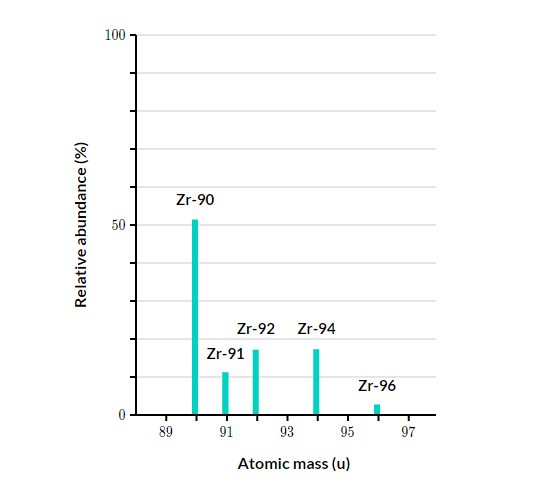
Câu 6: Trong tự nhiên, zirconium (kí hiệu Zr) khi phân tích phổ khối lượng như biểu đồ và bảng sau:
|
Khối lượng nguyên tử (m) |
90 |
91 |
92 |
94 |
96 |
|
% đồng vị |
51,45 |
11,22 |
17,15 |
17,38 |
2,8 |
Nguyên tử khối trung bình của zirconium là
A. 91,32.
B. 92,32.
C. 93,21.
D. 92,31.
Xem thêm các Công thức Hóa học lớp 10 quan trọng hay khác:
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)

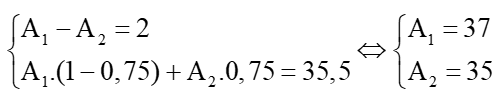



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

