Công thức bảo toàn electron (hay, chi tiết)
Bài viết Công thức bảo toàn electron hay nhất, chi tiết với bài tập minh họa có lời giải sẽ giúp học sinh nắm vững Công thức bảo toàn electron từ đó biết cách làm bài tập về bảo toàn electron.
Công thức bảo toàn electron (hay, chi tiết)
Công thức bảo toàn electron giúp chúng ta tính toán nhanh gọn và chính xác các bài toán liên quan đến phản ứng oxi hóa - khử. Bài viết dưới đây sẽ giúp các em hiểu rõ vấn đề này.
1. Công thức bảo toàn electron
- Phát biểu định luật: Trong phản ứng oxi hóa khử, tổng số electron nhường luôn bằng tổng số electron nhận
∑enhường = ∑e nhận
Hệ quả: ∑nenhường = ∑nenhận
- Các bước áp dụng:
Bước 1: Viết sơ đồ phản ứng
Bước 2: Xác định chất khử, chất oxi hóa. Viết bán phản ứng. Tính số mol e nhường, nhận.
Bước 3: Áp dụng công thức bảo toàn electron:
∑e nhường = ∑e nhận
Tính toán theo yêu cầu đề bài.
Ví dụ: Cho 7,8g hỗn hợp bột kim loại Mg và Al tác dụng với dd HCl dư thu được 8,96l H2 ở đktc. Khối lượng các kim loại Mg và Al trong hỗn hợp lần lượt là
A. 2,4g và 5,4 g B. 5,4g và 2,4g
C. 1,2g và 5,4g D. 3,9g và 2,6g
Hướng dẫn giải:
Bước 1: Sơ đồ phản ứng 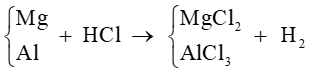
nH2 = 0,4 mol
Bước 2: Viết bán phản ứng
Quá trình oxi hóa: Quá trình khử:
Mg0 -> Mg+2 + 2e 2H+1 + 2e -> H02
x 2x 0,8 - > 0,4 mol
Al0 -> Al+3 + 3e
y 3y mol
∑ne nhường = 2x + 3y
∑nenhận = 0,8 mol
Bước 3: Áp dụng định luật bản toàn electron:
∑nenhường =∑nenhận
→ 2x + 3y = 0,8 (1)
mhỗn hợp = 7,8 gam
→ 24x + 27y = 7,8 (2)
Từ (1) và (2) → 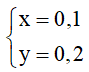 →
→ 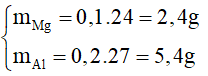
2. Bạn nên biết
Sử dụng linh hoạt định luật bảo toàn electron kết hợp với định luật bảo toàn nguyên tố và định luật bảo toàn khối lượng trong giải bài tập hóa học.
- Định luật bảo toàn khối lượng: “Trong một phản ứng hóa học, tổng khối lượng của các chất sản phẩm bằng tổng khối lượng của các chất tham gia phản ứng”.
Phương trình phản ứng: A + B → C + D
Áp dụng định luật bảo toàn khối lượng: mA + mB = mC + mD
- Định luật bảo toàn nguyên tố: “Tổng số mol nguyên tử của một nguyên tố X bất kỳ trước và sau phản ứng luôn bằng nhau”
3. Mở rộng bảo toàn electron
- Áp dụng định luật bảo toàn electron tính nhanh các bài toán kim loại phản ứng hết với dung dịch axit
∑ nKl..hóa trị= ∑nkhi(NH4+) . Số e nhận
Trong đó, các sản phẩm khử thường gặp:
|
Khí ( hoặc NH4+) |
NO2 |
NO |
N2O |
N2 |
NH4+ |
H2 |
SO2 |
H2S |
S |
Số e nhận |
1 |
3 |
8 |
10 |
8 |
2 |
2 |
8 |
6 |
4. Bài tập minh họa bảo toàn electron
Câu 1: Hòa tan 7,84 gam Fe vào 200 ml dung dịch hỗn hợp 2 axit HCl 0,15M và H2SO4 0,25M thấy thoát ra V lít khí H2 (đktc). Giá trị của V là
A. 1,456 lít B. 0,45 lít C. 0,75 lít D. 0,55 lít
Hướng dẫn giải:
nFe = 0,14 mol
nH+ = nHCL + 2nH2SO4 0,13 mol
Quá trình oxi hóa (nhường e) Quá trình khử: (nhận e)
Fe0 -> Fe+2 + 2e 2H+1 + 2e -> H02
bài ra: 0,14 -> 0,28 0,13 -> 0,13 -> 0,065
∑ne nhường tối đa = 0,28 mol ∑ne nhận tối đa= 0,13 mol
→ ∑ne nhường tối đa > ∑ne nhận tối đa
→ Fe dư, chuyển hết thành H2
→ nH2 = 0,065 mol → V = 1,456 lít
→ Chọn A
Câu 2: Đốt cháy hoàn toàn 7,2 gam kim loại M (có hóa trị n không đổi trong hợp chất) trong hỗn hợp khí Cl2 và O2. Sau phản ứng thu được 23,0 gam chất rắn và thể tích hỗn hợp khí đã phản ứng là 5,6 lít (đktc). Kim loại M là
A. Mg B. Ca C. Be D. Cu
Hướng dẫn giải:
n hỗn hợp khí = ncl2 + n02= 0,25 mol (1)
Áp dụng định luật bảo toàn khối lượng: mkim loại + mhỗn hợp khí = mrắn
→ mcl2 + mo2= 23 – 7,2 = 15,8 → = 15,8 (2)
Từ (1) và (2) → 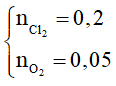
M0 → M+n + ne Cl20 + 2e -> 2Cl-1
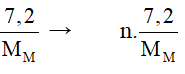 0,2 → 0,4
0,2 → 0,4
O02 + 4e -> 2O-2
0,05 → 0,2
∑ne nhường = 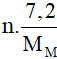 mol ∑ne nhận = 0,6 mol
mol ∑ne nhận = 0,6 mol
Áp dụng định luật bảo toàn electron: ∑nenhường = ∑nenhận
→ 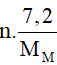 = 0,6 → MM = 12n
= 0,6 → MM = 12n
→ n = 2; MM = 24 (Mg)
→ Chọn A
Câu 3: Hòa tan hoàn toàn 19,2 gam Cu trong dung dịch HNO3 đặc, nóng thu được V lít khí NO2 (đktc). Giá trị của V là
A. 4,48
B. 13,44
C. 8,96
D. 6,72
Hướng dẫn giải:
nCu = 0,3 mol
∑nKl..Hóa trị=∑nkhi(NH4+) . Số e nhận
-> 0,3.2 = 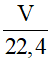 . 1
. 1
-> V = 13,44 lít
-> Chọn B
Xem thêm các Công thức Hóa học lớp 10 quan trọng hay khác:
Công thức tính nhanh khối lượng muối clorua tạo thành sau phản ứng
Công thức tính nhanh số mol OH- khi cho SO2 với dung dịch kiềm
Công thức tính nhanh số mol OH- khi cho H2S tác dụng với dung dịch kiềm
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

