Công thức tính hiệu độ âm điện (hay, chi tiết)
Bài viết Công thức tính hiệu độ âm điện hay nhất, chi tiết với bài tập minh họa có lời giải sẽ giúp học sinh nắm vững Công thức tính hiệu độ âm điện từ đó biết cách làm bài tập về tính hiệu độ âm điện.
Công thức tính hiệu độ âm điện (hay, chi tiết)
Hiệu độ âm điện cho ta dự đoán về mặt lý thuyết liên kết trong phân tử. Vậy công thức hiệu tính hiệu độ âm điện như thế nào? Cách dự đoán liên kết dựa vào hiệu độ âm điện ra sao? Bài viết này sẽ giúp các em hiểu rõ điều này.
1. Công thức tính hiệu độ âm điện
- Giả sử hợp chất có dạng AxBy.
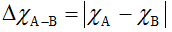
Trong đó:
+ 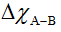 Hiệu độ âm điện
Hiệu độ âm điện
+ 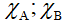 : Độ âm điện của A và B
: Độ âm điện của A và B
Chú ý: Do đặt phép tính trong dấu giá trị tuyệt đối, nên hiệu độ âm điện luôn ≥ 0.
Ví dụ:
Tính hiệu độ âm điện của Na và Cl trong phân tử NaCl, biết độ âm điện của Cl là 3,16; độ âm điện của Na là 0,93.
Hướng dẫn:
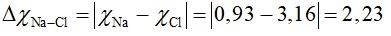
- Hiệu độ âm điện giúp đánh giá loại liên kết trong phân tử hợp chất một cách định tính.
2. Bạn nên biết
- Độ âm điện của một nguyên tử đặc trưng cho khả năng hút electron của nguyên tử đó khi hình thành liên kết hóa học.
- Dưới đây là bảng độ âm điện của nguyên tử một số nguyên tố nhóm A theo Pau – linh
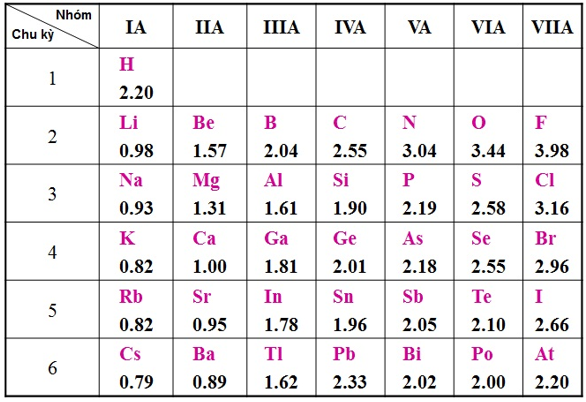
3. Mở rộng tính hiệu độ âm điện
Người ta phân loại một cách tương đối loại liên kết hóa học theo quy ước kinh nghiệm dựa vào độ âm điện của Pau – linh như sau:
Hiệu độ âm điện |
Loại liên kết |
Từ 0 đến < 0,4 |
Liên kết cộng hóa trị không cực |
Từ 0,4 đến < 1,7 |
Liên kết cộng hóa trị có cực |
≥ 1,7 |
Liên kết ion |

4. Bài tập minh họa tính hiệu độ âm điện
Câu 1: Dựa vào hiệu độ âm điện, hãy xác định loại liên kết trong phân tử HCl (biết độ âm điện của H là 2,2; độ âm điện của Cl là 3,16)
Hướng dẫn
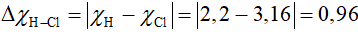
Có 0,4 < 0,96 < 1,7, vậy liện kết giữa H và Cl là liên kết cộng hóa trị có cực.
Câu 2: Cho biết độ âm điện của Ca = 1,00; Al = 1,61; Cl = 3,16; S = 2,58. Trong các hợp chất CaS, CaCl2, Al2S3; AlCl3. Số hợp chất có liên kết ion là
A. 1. B. 2. C. 3. D. 4.
Hướng dẫn:
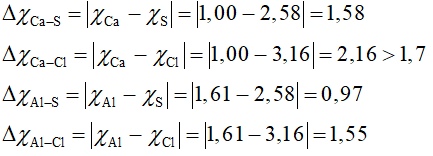
Vậy chỉ có hợp chất CaCl2 có liên kết ion.
Đáp án A
5. Bài tập tự luyện tính hiệu độ âm điện
Câu 1: Cho độ âm điện của các nguyên tử: O (3,44); Na (0,93); Mg (1,31); Cl (3,16). Trong các phân tử sau phân tử nào có độ phân cực lớn nhất?
A. NaCl.
B. MgO.
C. MgCl2.
D. Cl2O.
Câu 2: Cho độ âm điện của các nguyên tử: O (3,44); Na (0,93); H (2,2); S (2,58); Si (1,9). Trong các hợp chất sau đây, hợp chất nào có liên kết ion?
A. Na2O.
B. H2O.
C. SO2.
D. SiO2.
Câu 3: Cho độ âm điện của các nguyên tử: O (3,44); Mg (1,31); Cl (3,16); Ca (1,00); P (2,19). Trong các hợp chất sau đây, hợp chất nào có liên kết cộng hóa trị?
A. MgO.
B. MgCl2.
C. CaO.
D. P2O5.
Câu 4: Cho độ âm điện của các nguyên tử: H (2,2); C(2,55); Si (1,9); F (3,98). Trong các hợp chất sau đây, hợp chất nào có liên kết cộng hóa trị phân cực?
A. H2.
B. CH4.
C. SiH4.
D. HF.
Câu 5: Cho độ âm điện của các nguyên tử: Ba (0,89); H (2,2); C (2,55); Cl (3,16); Ca (1,00). Trong các hợp chất sau đây: BaCl2, CaCl2, H2, HCl, CH4, Cl2. Số hợp chất có liên kết ion, liên kết cộng hóa trị không phân cực, liên kết cộng hóa trị phân cực lần lượt là
A. 2, 2, 2.
B. 3, 2, 1.
C. 2, 1, 3.
D. 2. 3. 1.
Xem thêm các Công thức Hóa học lớp 10 quan trọng hay khác:
Công thức tính nhanh khối lượng muối clorua tạo thành sau phản ứng
Công thức tính nhanh số mol OH- khi cho SO2 với dung dịch kiềm
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

