Công thức hiđroxit cao nhất (hay, chi tiết)
Bài viết Công thức hiđroxit cao nhất hay nhất, chi tiết với bài tập minh họa có lời giải sẽ giúp học sinh nắm vững Công thức hiđroxit cao nhất từ đó biết cách làm bài tập về hiđroxit cao nhất.
Công thức hiđroxit cao nhất (hay, chi tiết)
Ta đã biết trong một chu kỳ khi đi từ trái qua phải theo chiều tăng của điện tích hạt nhân, tính bazơ của các hiđroxit tương ứng yếu dần, đồng thời tính axit của chúng mạnh dần. Vậy cách xác định hiđroxit cao nhất của các nguyên tố nhóm A là như thế nào? Bài viết này sẽ giúp các em giải quyết vấn đề này.
1. Công thức hiđroxit cao nhất
- Hóa trị cao nhất trong hợp chất với hiđroxit của nguyên tố nhóm A = số thứ tự nhóm.
Giả sử n là số thứ tự nhóm A. Ta có:
+ Nếu R là kim loại (n = 1, 2, 3): Công thức hiđroxit cao nhất là R(OH)n
+ Nếu R là phi kim (n = 4, 5, 6, 7): Từ công thức ban đầu R(OH)n chuyển thành HnROn.
Sau đó tiếp tục trừ đi số nguyên lần phân tử nước (H2O) đến khi công thức tới dạng HROx hoặc H2ROx thì ngưng vì nó không còn dư nước để trừ nữa.
Trừ một số trường hợp đặc biệt như: H3PO4; …
Ví dụ: Cho các nguyên tố cùng thuộc chu kì 3: 11Na, 13Al và 17Cl. Viết công thức hiđroxit cao nhất của các nguyên tố.
Hướng dẫn giải:
+) 11Na (1s22s22p63s1) → Na thuộc chu kì 3, nhóm IA → n = 1
→ Công thức hiđroxit cao nhất là NaOH.
+) 13Al (1s22s22p63s23p1) → Al thuộc chu kì 3, nhóm IIIA → n = 3
→ Công thức hiđroxit cao nhất là Al(OH)3.
+) 17Cl (1s22s22p63s23p5) → Cl thuộc chu kì 3, nhóm VIA → n = 7
Cl(OH)7 H7ClO7 HClO4.3H2O
→ Công thức hiđroxit cao nhất là HClO4
2. Bạn nên biết
- Trong 1 chu kì: từ trái sang phải theo chiều tăng dần của điện tích hạt nhân, tính bazơ của oxit và hiđroxit tương ứng giảm dần, đồng thời tính axit của chúng tăng dần.
Nhóm |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
|
Oxit |
Na2O basic oxide |
MgO Oxit bazơ |
Al2O3 Oxit lưỡng tính |
SiO2 Oxit axit |
P2O5 Oxit axit |
SO3 Oxit Axit |
Cl2O7 Oxit axit |
|
Hidroxit |
NaOH Bazơ mạnh kiềm |
Mg(OH)2 Bazơ yếu |
Al(OH)3 Hiđroxit lưỡng tính |
H2SiO3 Axit yếu |
H3PO4 Axit trung bình |
H2SO4 Axit mạnh |
HClO4 Axit rất mạnh |
|
Bazơ |
Axit |
||||||
- Trong 1 nhóm A : Đi từ trên xuống, theo chiều tăng dần điện tích hạt nhân tính bazơ của các oxit và hiđroxit tăng dần, tính axit giảm dần.
3. Bài tập minh họa hiđroxit cao nhất

Câu 1: Cho các nguyên tố sau: K( Z =19) , Mg( Z =12), S( Z = 16). Công thức hiđroxit tương ứng là:
A. KOH, MgOH, H2SO4 . B. K(OH)2, MgOH, H2SO4.
C. KOH, Mg(OH)2, H2SO3. D. KOH, Mg(OH)2, H2SO4.
Hướng dẫn:
+) K (Z =19). Cấu hình electron của K là: 1s22s22p63s23p64s1 → K thuộc chu kì 4, nhóm IA.
→ Công thức hiđroxit cao nhất là KOH.
+) Mg (Z =12). Cấu hình electron của Mg là: 1s22s22p63s2 → Mg thuộc chu kì 3, nhóm IIA.
→ Công thức hiđroxit cao nhất là Mg(OH)2.
+) S (Z = 16). Cấu hình electron của S là: 1s22s22p63s23p4 → S thuộc chu kì 3, nhóm VIA.
S(OH)6 <-> H6SO6 <-> H2SO4.2H2O
→ Công thức hiđroxit cao nhất là: H2SO4
→ Chọn D.
Câu 2: Hiđroxit cao nhất của một nguyên tố có dạng HRO4. Biết R cho hợp chất khí với hiđro chứa 2,74%H theo khối lượng. Nguyên tố R là
A. P. B. I. C. Br. D. Cl.
Hướng dẫn
Hiđroxit cao nhất của một nguyên tố có dạng HRO4
Giả sử gọi: n là số thứ tự nhóm A; n = 4, 5, 6, 7.
y là số nguyên lần phân tử nước.
Ta có:
HRO4.yH2O = R(OH)n
Bảo toàn nguyên tố H → 1 +2y = n
Bảo toàn nguyên tố O → 4 + y = n
→ 1 + 2y = 4 + y → y = 3, n = 7
→ R thuộc nhóm VIIA.
%mH = 2,74% = 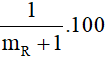
→ mR 35,5 (g/mol) → R là Cl
→ Chọn D
Câu 3: Hợp chất khí với hiđro của một nguyên tố ứng với công thức RH4. Hiđroxit cao nhất của nó chứa 3,226% H (theo khối lượng ). Nguyên tố R là
A. Si B. C C. S D. Ca
Hướng dẫn
Hợp chất khí với hiđro của R là: RH4
→ R thuộc nhóm IVA
→ R(OH)4 <-> H4RO4 <-> H2RO3.H2O
→ Công thức hiđroxit cao nhất có dạng H2RO3
%mH = 3,226% =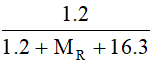 .100
.100
→ MR ≈12 (g/mol) → R là cacbon (C)
→ Chọn B.
Xem thêm các Công thức Hóa học lớp 10 quan trọng hay khác:
Công thức xác định hai nguyên tố thuộc hai chu kì liên tiếp trong cùng một nhóm A
Công thức xác định hai nguyên tố thuộc hai nhóm A liên tiếp trong cùng một chu kì
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

