Công thức tính biến thiên enthalpy theo nhiệt tạo thành chuẩn lớp 10 (hay, chi tiết)
Bài viết Công thức tính biến thiên enthalpy theo nhiệt tạo thành chuẩn lớp 10 trình bày đầy đủ công thức, ví dụ minh họa có lời giải chi tiết và các bài tập tự luyện giúp học sinh nắm vững kiến thức trọng tâm về Công thức tính biến thiên enthalpy theo nhiệt tạo thành chuẩn từ đó học tốt môn Hóa học.
Công thức tính biến thiên enthalpy theo nhiệt tạo thành chuẩn lớp 10 (hay, chi tiết)
(199k) Xem Khóa học Hóa 10 KNTTXem Khóa học Hóa 10 CDXem Khóa học Hóa 10 CTST
I. Công thức tính biến thiên enthalpy theo nhiệt tạo thành chuẩn
Giả sử có phản ứng tổng quát:
aA + bB → mM + nN
Biến thiên enthalpy chuẩn của phản ứng này được tính theo công thức:
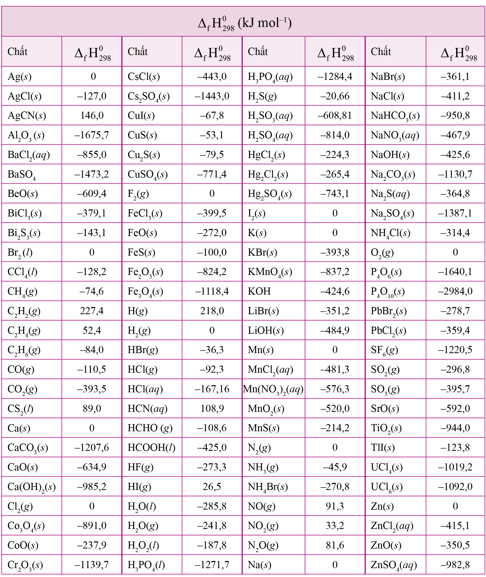
Giá trị enthalpy tạo thành chuẩn của một số chất được cho ở bảng sau:
(Trích phụ lục 3 – SGK Hóa học 10 – Cánh diều)
Chú ý: Các phản ứng tỏa nhiệt () thường diễn ra thuận lợi hơn các phản ứng thu nhiệt ().
II. Ví dụ minh họa tính biến thiên enthalpy theo nhiệt tạo thành chuẩn
Ví dụ 1: Cho phản ứng:
Tính nhiệt tạo thành chuẩn của khí SO2 biết .
Hướng dẫn giải:
Ta có:
Ví dụ 2: Cho phản ứng: 2NaCl (s) → 2Na (s) + Cl2 (g)
Biết . Biến thiên enthalpy chuẩn của phản ứng này là
A. -822,4 kJ.
B. +822,4 kJ.
C. -411,2 kJ.
D. +411,2 kJ.
Hướng dẫn giải:
Đáp án đúng là: B
Biến thiên enthalpy chuẩn của phản ứng:
= 2 × 0 + 1 × 0 – 2 × (-411,2) = 822,4 (kJ).
III. Bài tập vận dụng tính biến thiên enthalpy theo nhiệt tạo thành chuẩn
Câu 1: Cho phản ứng hóa học xảy ra ở điều kiện chuẩn như sau:
2NO2(g) (đỏ nâu) → N2O4(g) (không màu)
Biết NO2 và N2O4 có nhiệt tạo thành chuẩn tương ứng là 33,18 kJ/mol và 9,16 kJ/mol. Phát biểu nào sau đây là đúng?
A. Phản ứng tỏa nhiệt, NO2 bền vững hơn N2O4.
B. Phản ứng thu nhiệt, NO2 bền vững hơn N2O4.
C. Phản ứng tỏa nhiệt, N2O4 bền vững hơn NO2.
D. Phản ứng thu nhiệt, N2O4 bền vững hơn NO2.
Hướng dẫn giải
Đáp án đúng là: C
= 9,16 – 2.33,18 = -57,2 (kJ) < 0
Vậy phản biểu đúng là: phản ứng tỏa nhiệt, N2O4 bền hơn NO2.
Câu 2: Cho phản ứng sau:
CaCO3(s) → CaO(s) + CO2(g)
Biến thiên enthalpy chuẩn của phản ứng là
|
Chất |
CaCO3(s) |
CaO (s) |
CO2(g) |
|
(kJmol-1) |
-1 207 |
-635 |
-393,5 |
A. -178,5.
B. -185,7.
C. +178,5.
D. +235,5.
Hướng dẫn giải
Đáp án đúng là: C
(-635) + (-393,5) – (-1207) = +178,5 (kJ)
Câu 3: Cho phản ứng sau:
C(graphite) + O2(g) → CO2(g)
Biến thiên enthalpy chuẩn của phản ứng trên là (Biết nhiệt enthalpy tạo thành chuẩn (kJ/mol) của CO2 là -393,5).
A. +393,5 kJ.
B. +1966,5 kJ.
C. -393,5 kJ.
D. -1966,5 kJ.
Hướng dẫn giải
Đáp án đúng là: C
= (-393,5) – 0 – 0 = - 393,5 (kJ)
Câu 4: Cho phản ứng đốt cháy ethane:
C2H6 (g) + O2 (g) 2CO2 (g) + 3H2O (l)
Biến thiên enthalpy chuẩn của phản ứng đốt cháy ethane là
Biết:
|
Chất |
C2H6 (g) |
O2 (g) |
CO2 (g) |
H2O (l) |
|
(kJmol-1) |
-87,1 |
0 |
-393,5 |
-285,8 |
A. - 1559,7 (kJ).
B. +1559,7 (kJ).
C. - 1644,4 (kJ).
D. +1644,4 (kJ).
Hướng dẫn giải
Đáp án đúng là: A
Tổng nhiệt tạo thành các chất đầu là:
= (-84,7.1) + 0.= - 84,7 (kJ)
Tổng nhiệt tạo thành các chất sản phẩm là:
= (-393,5.2) + (-285,8.3) = - 1644,4 (kJ)
⇒ Biến thiên enthalpy của phản ứng:
= - 1559,7 (kJ)
Câu 5: Cho phản ứng sau:
Biết nhiệt tạo thành chuẩn của CO2:
Nhiệt tạo thành chuẩn của CO là
A. –110,5 kJ/mol.
B. +110,5 kJ/mol.
C. –141,5 kJ/mol.
D. –221,0 kJ/mol.
Hướng dẫn giải
Đáp án đúng là: A
⇒ - 283 = - 393,5.1 –
⇒
Câu 6: Cho phản ứng nhiệt nhôm sau:
2Al(s) + Fe2O3(s) 2Fe(s) + Al2O3(s)
Biến thiên enthalpy chuẩn của phản ứng nhiệt nhôm là
Biết:
|
Chất |
Al (s) |
Fe2O3 (s) |
Fe (s) |
Al2O3 (s) |
|
(kJmol-1) |
0 |
-825,5 |
0 |
-1676,0 |
A. +850,5 kJ.
B. - 850,5 kJ.
C. -839 kJ.
D. +839 kJ.
Hướng dẫn giải
Đáp án đúng là: B
2Al(s) + Fe2O3(s) 2Fe(s) + Al2O3(s)
= 2.0 + (-1676,00) – 2.0 – (-825,5) = -850,5 kJ.
Câu 7: Cho phản ứng hóa học sau:
Biết:
|
Chất |
C2H4 (g) |
H2O (l) |
C2H5OH (l) |
|
(kJmol-1) |
+52,47 |
-285,84 |
-277,63 |
Nhận xét nào sau đây là đúng?
A. Phản ứng tỏa nhiệt.
B. Phản ứng thu nhiệt.
C. Biến thiên enthalpy chuẩn của phản ứng lớn hơn 0.
D. Biến thiên enthalpy chuẩn của phản ứng bằng 0.
Hướng dẫn giải
Đáp án đúng là: A
Lời giải:
Biến thiên enthalpy chuẩn của phản ứng:
= - 277,63 - (+52,47) - (-285,84) = -44,26 kJ
Do nên phản ứng toả nhiệt.
Câu 8: Cho phản ứng xảy ra trong quá trình luyện gang như sau:
Fe2O3(s) + 3CO(g) → 2Fe(s) + 3CO2(g) (1)
Biến thiên enthalpy chuẩn của phản ứng là
Biết:
|
Chất |
CO (s) |
Fe2O3 (s) |
Fe (s) |
CO2 (g) |
|
(kJmol-1) |
-110,5 |
-824,2 |
0 |
-393,5 |
A. +24,8 kJ.
B. -24,8 kJ.
C. +28,4 kJ.
D. -28,4 kJ.
Hướng dẫn giải
Đáp án đúng là: B
Biến thiên enthalpy chuẩn của phản ứng:
Câu 9: Muối ammonium bicarbonate (NH4HCO3) được sử dụng làm bột nở, giúp cho bánh nở to, xốp và mềm. Dựa vào phản ứng và các dữ kiện sau hãy lựa chọn cách bảo quản ammonium bicarbonate đúng?
NH4HCO3 (s) NH3 (g) + CO2 (g) + H2O (g)
|
Chất |
NH4HCO3 (s) |
NH3 (g) |
CO2 (g) |
H2O (g) |
|
(kJmol-1) |
–849,40 |
–46,11 |
–393,51 |
–241,82 |
A. Bảo quản nơi thoáng mát, khô ráo, có nhiệt độ cao, nhiều ánh nắng Mặt Trời.
B. Bảo quản nơi thoáng mát, khô ráo, nhiều ánh sáng Mặt Trời.
C. Bảo quản nơi thoáng mát, tránh ánh sáng Mặt Trời và tránh nhiệt độ cao.
D. Bảo quản nơi kín gió, có ánh sáng Mặt Trời.
Hướng dẫn giải
Đáp án đúng là: C
= –46,11– 393,51– 241,82 – (–849,40) = 167,96 kJ > 0.
Phản ứng trên là phản ứng thu nhiệt, do vậy ở nơi có nhiệt độ cao (hay tiếp xúc trực tiếp ánh sáng mặt trời) bột nở sẽ có thể bị phân hủy tạo thành các khí.
Do đó cách bảo quản bột nở: Bảo quản nơi thoáng mát, tránh ánh sáng Mặt Trời và tránh nhiệt độ cao.
Câu 10: Muối ammonium chloride rắn khi hòa vào nước cất sẽ xảy ra phản ứng:
NH4Cl (s) → NH4Cl (aq)
Biết enthalpy tạo thành chuẩn của NH4Cl (s) và NH4Cl (aq) lần lượt là –314,43 kJ mol-1 và –299,67 kJ mol-1. Biến thiên enthalpy chuẩn của phản ứng là
A. +14,76 kJ.
B. -14,76 kJ.
C. - 614,1 kJ.
D. + 614,1 kJ.
Hướng dẫn giải
Đáp án đúng là: A
Biến thiên enthalpy chuẩn của phản ứng:
= –299,67 + 314,43 = 14,76 kJ.
(199k) Xem Khóa học Hóa 10 KNTTXem Khóa học Hóa 10 CDXem Khóa học Hóa 10 CTST
Xem thêm các bài viết về công thức Hóa học 10 hay, chi tiết khác:
Công thức tính biến thiên enthalpy chuẩn theo năng lượng liên kết
Công thức tính tốc độ tức thời của phản ứng hay công thức định luật tác dụng khối lượng
Tủ sách VIETJACK shopee lớp 6-8 (2025):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài 500 Công thức, Định Lí, Định nghĩa Toán, Vật Lí, Hóa học, Sinh học được biên soạn bám sát nội dung chương trình học các cấp.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)







 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

