Trọn bộ Công thức Hóa học lớp 11 Học kì 1, Học kì 2 quan trọng
Trọn bộ Công thức Hóa học lớp 11 Học kì 1, Học kì 2 quan trọng sẽ giúp học sinh nắm vững công thức, dễ dàng tổng kết lại kiến thức đã học từ đó có kế hoạch ôn tập hiệu quả để đạt kết quả cao trong các bài thi môn Hóa học 11.
Trọn bộ Công thức Hóa học lớp 11 Học kì 1, Học kì 2 quan trọng
Chương 1: Sự điện li
Chương 2: Nitơ - Photpho
Chương 3: Cacbon - Silic
Chương 4: Đại cương về hóa học hữu cơ
Chương 5 : hydrocarbon no
Chương 6 : hydrocarbon không no
Chương 7: hydrocarbon thơm. Nguồn hydrocarbon thiên nhiên. Hệ thống hóa về hydrocarbon?/b>
Chương 8: Dẫn xuất halogen - Ancol - Phenol
Công thức tính nhanh số đồng phân ancol no, đơn chức, mạch hở
Công thức tính số ete tối đa thu được từ hỗn hợp n ancol đơn chức
Chương 9: Anđehit - ketone - carboxylic acid
Công thức tính nhanh số đồng phân Anđehit no, đơn chức, mạch hở
Công thức tính nhanh số đồng phân carboxylic acid no, đơn chức, mạch hở
Công thức tính nhanh số đồng phân ketone no, đơn chức, mạch hở
Công thức tính độ điện li
Chất điện li là chất tan trong nước và phân li ra ion. Vậy để đánh giá đâu là chất điện li mạnh, đâu là chất điện li yếu người ta dựa vào đại lượng nào? Bài viết dưới đây sẽ trả lời câu hỏi này.
1.Công thức tính độ điện li
Độ điện li ( anpha) của chất điện li là tỉ số giữa số phân tử phân li thành ion và tổng số phân tử ban đầu.
Biểu thức : 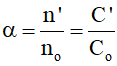
Trong đó:
n' là số mol bị phân li thành ion ; no số mol ban đầu
C' nồng độ mol/l bị phân li, Co nồng độ mol/l ban đầu
Giá trị có thể tính theo đơn vị % ( .100)
2. Bạn nên biết
- Các trường hợp của độ điện li:
+ ∝ = 1 : chất điện li mạnh
+ 0 < ∝ < 1: chất điện li yếu
+ ∝ = 0: chất không điện li
-Độ điện phụ thuộc vào các yếu tố :
+ Nồng độ chất tan: tỉ lệ nghịch
+ Nhiệt độ của dung dịch
3. Bài tập minh họa
Câu 1: Độ điện li của 100ml dung dịch formic acid 0,46% (D=1g/ml) có pH=3 là
A. ∝ =1,5%.
B. ∝ = 0,5%.
C. ∝ = 1%.
D. ∝ = 2%.
Hướng dẫn
[H+] = 10-3M
-> nH+ = 0,1.10-3 = 10-4 mol
mddHCOOH = 1.100= 100gam
-> mHCOOH = 100.0,46% =0,46 gam
-> mHCOOH = 0,46: 46 = 10-2 mol
-> ∝= 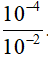 100= 1%
100= 1%
Đáp án C
Câu 2:Trong 100ml dung dịch axit nitơ ở nhiệt độ nhất định có 5,64.1021 phân tử HNO2 và 3,6.1020 ion NO2- . Độ điện li của axit nitơ trong dung dịch ở nhiệt độ trên là:
A. 4%
B. 5%
C. 6%
D. 7%
Hướng dẫn
Số phân tử HNO2 phân li thành ion là : n’=3,6.1020 phân tử
Số phân tử HNO2 hòa tan trong dung dịch là:
no = 3,6.1020 + 5,64.1021 = 6.1021 phân tử
Độ điện li là:
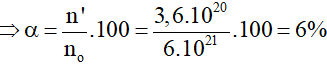
Đáp án C
Câu 3: Một lít dung dịch CH3COOH 0,01M có chứa tổng số 6,28.1021 ion và phân tử CH3COOH. Độ điện li của axit này là:
A. 4,3%
B. 4,0%
C. 5,3%
D. 5,0%
Hướng dẫn
nCH3COOH = 1.0,01 =0,01 mol
Tổng số phân tử CH3COOH hòa tan là: no = 0,01.6,02.1023 = 6,02.1021
Phương trình điện li:
CH3COOH 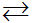 CH3COO- + H+
CH3COO- + H+
Bd n0
CB n0 - n' n' n'
Dung dịch chứa tổng số 6,28.1021 ion và phân tử CH3COOH
-> 6,28 .1021 = no - n' + n' +n'
-> 6,28.1021 = 6,02.1021 + n'
-> n' = 0,26.1021
-> 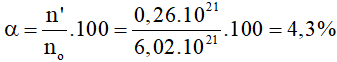
Đáp án A
Công thức xác định hằng số điện li
Sự điện li của các chất điện li yếu là một cân bằng điện li. Cũng giống như mọi cân bằng hóa học khác, cân bằng điện li cũng có hằng số cân bằng. Vậy xác định hằng số này như thế nào? Muốn biết cách tính hằng số điện li, các em không thể bỏ qua bài viết dưới đây.
1.Công thức xác định hằng số điện li
Xét cân bằng: AX 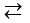 A+ + X¯(*)
A+ + X¯(*)
Khi tốc độ thuận bằng tốc độ nghịch trong dung dịch xuất hiện cân bằng điện li.
Hằng số điện li xét đối với cân bằng (*) được xác định.
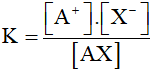
Trong đó [A+], [X-], [AX] là nồng độ các chất ở thời điểm cân bằng.
2. Bạn nên biết
Hằng số điện li chỉ phụ thuộc vào nhiệt độ, không phụ thuộc vào nồng độ.
3. Mở rộng
Nước là chất điện li rất yếu
Phương trình điện li: H2O 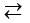 H- + OH-
H- + OH-
Hằng số cân bằng của phản ứng: 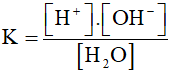
Tích số ion của nước : KH2O = K.[H2O] = [H+] .[OH-]
Tích số ion của nước là hằng số xác định ở nhiệt độ xác định: Ở 25°C ,
KH2O = [H+]. [OH-] = 10-14
+ [H+] > [OH-] dung dịch có môi trường axit.
+ [H+] < [OH-] dung dịch có môi trường bazơ.
+ [H+] = [OH-] dung dịch có môi trường trung tính.
4. Bài tập minh họa
Câu 1: Cho dung dịch CH3COOH 0,1M. Hằng số phần li của acetic acid bằng 1,75.10-5. Độ điện li của dung dịch trên là:
A. 1,31.10-1
B. 1,31. 10-2
C. 1,31. 10-3
D. 1,31. 10-4
Hướng dẫn
CH3COOH 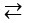 CH3COO- + H+
CH3COO- + H+
Bd 0,1
Pli 0,1∝ 0,1∝ 0,1∝
CB 0,1.(1-∝) 0,1∝ 0,1∝
K= 1,75.10-5 = 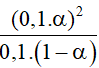
-> ∝ = 1,31.10-2
Đáp án B
Câu 2: Tính hằng số điện li của acetic acid, biết rằng dung dịch 0,1M có độ điện li là 1,32%?
A.1,77.10-5
B. 1,97.10-5
C. 2,77.10-5
D. 2,97.10-5
Hướng dẫn
CH3COOH 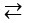 CH3COO- + H+
CH3COO- + H+
Bd 0,1
Pli 0,1∝ 0,1∝ 0,1∝
CB 0,1.(1-∝) 0,1∝ 0,1∝
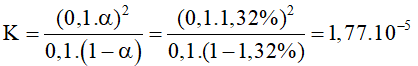
Đáp án A
Câu 3:Tính hằng số điện li của NH3, biết rằng dung dịch NH3 0,1 M có pH =11,13?
A. 1,8.10-4
B. 2,8.10-4
C. 1,8.10-5
D. 2,8.10-5
Hướng dẫn
[H+] = 10-11,13 => [OH-] = 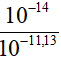 = 10-2,87 M
= 10-2,87 M
NH3 + H2O 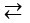 NH4+ + OH-
NH4+ + OH-
Bd 0,1
Pli 10-2,87 <- 10-2,87 <- 10-2,87
CB 0,0986 10-2,87 10-2,87 (M)
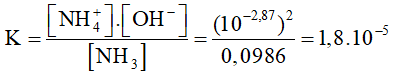
Đáp án C
..........................
..........................
..........................
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

