Công thức tính số mol OH- ( hoặc CO2) khi cho CO2 tác dụng với dung dịch kiềm (hay, chi tiết)
Bài viết Công thức tính số mol OH- ( hoặc CO2) khi cho CO2 tác dụng với dung dịch kiềm hay nhất, chi tiết với bài tập minh họa có lời giải sẽ giúp học sinh nắm vững Công thức tính số mol OH- ( hoặc CO2) khi cho CO2 tác dụng với dung dịch kiềm từ đó biết cách làm bài tập về tính số mol OH- ( hoặc CO2) khi cho CO2 tác dụng với dung dịch kiềm.
Công thức tính số mol OH- ( hoặc CO2) khi cho CO2 tác dụng với dung dịch kiềm (hay, chi tiết)
Dạng bài khi sục khí CO2 vào dung dịch kiềm là bài toán rất hay gặp trong đề thi. Nhiều bạn còn luống cuống trong khâu xử lý hoặc làm sai do bị đề bẫy. Bài viết dưới đây sẽ giúp các em tìm ra đáp án chính xác và nhanh nhất.
1. Công thức tính số mol OH- ( hoặc CO2) khi cho CO2 tác dụng với dung dịch kiềm
A. Bài toán CO2 dẫn vào dung dịch NaOH (hoặc KOH)
Ví dụ:
CO2 + 2NaOH → Na2CO3 + H2O (1)
CO2 + NaOH → NaHCO3 (2)
Đặt 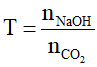
- Nếu T ≥ 2 : chỉ tạo muối Na2CO3 => nNaOHpu = 2nCO2 = 2nNa2CO3
- Nếu T ≤ 1 : chỉ tạo muối NaHCO3 => nNaOH = nNaHCO3 = nCO2pu
- Nếu 1 < T < 2 : tạo cả muối NaHCO3 và Na2CO3 => nCO32- = nOH- - nCO2
- Chất hấp thụ vào bình NaOH tăng :
m bình tăng = m dd tăng = m chất hấp thụ(CO2 + H2O có thể có)
Tương tự với KOH.
B. Bài toán CO2 dẫn vào dung dịch Ca(OH)2 hoặc Ba(OH)2:
Phương trình hóa học :
Ca(OH)2 + CO2 → CaCO3↓ + H2O (1)
Ca(OH)2 + 2CO2 → Ca(HCO3)2 (2)
Xét tỉ lệ: 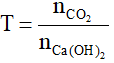
- Nếu T ≥ 1 : chỉ tạo muối CaCO3 => nCa(OH)2 = nCaCO3 = nCO2
- Nếu T ≤ 2 : chỉ tạo muối Ca(HCO3)2 => nCa(OH)2 = nCa(HCO3)2
- Nếu 1 < T < 2: tạo cả muối CaCO3 và Ca(HCO3)2 => n↓ = nOH- - nCO2
- Xét tương tự với Ba(OH)2
- Sự tăng giảm khối lượng dung dịch : Khi cho sản phẩm cháy vào bình Ca(OH)2 hay Ba(OH)2
m bình tăng = m hấp thụ
m dd tăng = m hấp thụ - m kết tủa
m dd giảm = m kết tủa – m hấp thụ
- Nếu không có các dữ kiện trên ta phải chia trường hợp để giải.
C. Bài toán cho CO2 vào hỗn hợp dung dịch chứa NaOH, Ca(OH)2 (hoặc NaOH, Ba(OH)2 hoặc KOH, Ca(OH)2 hoặc KOH, Ba(OH)2)
Phương trình:
CO2+ 2OH- -> CO32- + H2O (1)
CO2 + OH- -> HCO3- (2)
-Xét tỉ lệ: 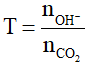
+Nếu T ≥ 2 : chỉ tạo muối => nOH-pu = 2n CO32- = 2nCO2
+Nếu T ≤ 1 : chỉ tạo muối HCO3- => nOH- =nHCO3- =nCO2pu
+Nếu 1 < T < 2 : tạo cả muối HCO3- và => nCO32- = nOH- - nCO2
-Dựa vào dữ kiện bài toán áp dụng định luật bảo toàn khối lượng, bảo toàn nguyên tố tìm số mol của HCO3- và rồi so sánh với số mol của Ca2+ để suy ra số mol kết tủa.
2. Bạn nên biết
Khi sục khí CO2 vào dung dịch kiềm thì xảy ra theo 2 giai đoạn sau:
CO2+ 2OH- -> CO32- + H2O (1)
Khi hết OH-, vẫn tiếp tục sục CO2 vào thì
CO2 + CO32- + H2O- -> 2HCO3- (2)
3. Mở rộng tính số mol OH- ( hoặc CO2) khi cho CO2 tác dụng với dung dịch kiềm
Khi sục khí SO2 vào dung dịch kiềm thì hiện tượng và cách giải sẽ tương tự với bài toán sục khí CO2 vào dung dịch kiềm.
SO2+ 2OH- -> SO32- + H2O (1)
SO2 + OH- -> HSO3- (2)
Ví dụ minh họa: Dẫn 2,24 lít khí SO2 (đkc) vào 200ml dung dịch KOH 1,5M. Vậy khi phản ứng xảy ra hoàn toàn thì thu được:
A. K2SO3 0,1M và KOH dư 0,4M
B. KHSO3 0,1M
C. K2SO3 0,5M và KOH dư 0,5M
D. KHSO3 0,1M và K2SO3 0,5M
Hướng dẫn
nSO2=0,1mol nKOH=0,3 mol
=> 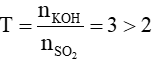
Chỉ tạo muối K2SO3 và dung dịch KOH dư
nK2SO3 = nCO2= 0,1 mol
=> 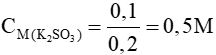
nKOH dư = 0,3 -2nCO2 =0,1 mol
=> 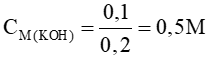
Đáp án C

4. Bài tập minh họa tính số mol OH- ( hoặc CO2) khi cho CO2 tác dụng với dung dịch kiềm
Câu 1: Sục 2,24 lít khí CO2 vào 200ml dung dịch NaOH 1M thu được dung dịch X. Tính khối lượng muối trong X?
A.15 g
B. 20 g
C. 10 g
D.10,6 g
Hướng dẫn
nCO2 = 0,1mol, nNaOH = 0,2 mol
=> 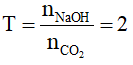
Dung dịch X chỉ chứa 1 muối là Na2CO3
=> nNa2CO3 = nCO2
=> mNa2CO3 = 0,1.106 = 10,6 gam
Đáp án D
Câu 2. Cho V lít (đktc) CO2 tác dụng với 200 ml dung dịch Ca(OH)2 1M thu được 10 gam kết tủa. Vậy thể tích V của CO2 là
A. 2,24 lít.
B. 6,72 lít.
C. 8,96 lít.
D. 2,24 hoặc 6,72 lít
Hướng dẫn
nCa(OH)2 =0,2 mol , nCaCO3 = 0,1 mol
TH1: Chỉ tạo muối CaCO3
=> nCO2 = nCaCO3 =0,1 mol
=> VCO2 = 0,1.22,4 =2,24 lít
TH2: Tạo hỗn hợp 2 muối Ca(HCO3)2
Bảo toàn nguyên tố Ca : nCa(HCO3)2 = nCa(OH)2- nCaCO3 =0,1mol
Bảo toàn nguyên tố C : => nCO2 = 2nCa(HCO3)2 + nCaCO3 = 0,3mol
=> VCO2 = 0,3.22,4 =6,72 lit
Đáp án D
Câu 3: Sục 3,36 lít khí CO2 (đktc) vào 500ml dd KOH 0,1M và Ba(OH)2 0,12M. Tính m kết tủa thu được?
A. 4,925 gam
B. 3,94 gam
C. 1,97 gam
D. 2,55 gam
Hướng dẫn: OH- Ba2+
nCO2 =0,15 mol , n OH-= 0,17 mol , nBa2+= 0,06 mol
Ta thấy: 1< T=1,133 < 2 tạo cả muối HCO3- và CO32-
Cách 1:
CO2 + 2OH- -> CO32- + H2O
0,085 0,17 -> 0,085
CO2 + CO32- + H2O -> 2HCO3-
0,065 -> 0,065 -> 0,13
nCO32-= 0,085 -0,065 =0,02 mol < nBa2+ =0,06 mol
n↓ = 0,02 mol
⇒ m↓ = 0,02 . 197 = 3,94g
Cách 2:
Ta có: => nCO32- = nOH- - nCO2 -> a = 0,17-0,15 a = 0,02 mol
nCO32- = 0,02 mol < nBa2+ = 0,06 mol
=> n↓ = 0,02 mol
⇒ m↓ = 0,02 . 197 = 3,94g
Đáp án B
Xem thêm các Công thức Hóa học lớp 11 quan trọng hay khác:
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

