Công thức tính pH trong dung dịch axit mạnh/bazơ mạnh (hay, chi tiết)
Bài viết Công thức tính pH trong dung dịch axit mạnh/bazơ mạnh hay nhất, chi tiết với bài tập minh họa có lời giải sẽ giúp học sinh nắm vững Công thức tính pH trong dung dịch axit mạnh/bazơ mạnh từ đó biết cách làm bài tập về tính pH trong dung dịch axit mạnh/bazơ mạnh.
Công thức tính pH trong dung dịch axit mạnh/bazơ mạnh (hay, chi tiết)
Ta đã biết, có thể đánh giá độ axit và độ kiềm của dung dịch bằng pH. Vậy pH của dung dịch axit mạnh và bazơ mạnh được xác định như thế nào? Để giải quyết thắc mắc trên các em hãy đọc bài viết bên dưới để có câu trả lời cho mình nhé.
1. Công thức tính pH trong dung dịch axit mạnh/bazơ mạnh
Nếu nồng độ axit hay bazơ khá lớn thì bỏ qua sự điện li của nước.
Dung dịch axit mạnh có pH là : pH = -lg[H+]
Dung dịch bazơ mạnh có pH là: pH = 14 - lg[OH-]
2. Bạn nên biết
- Dựa vào nồng độ H+ trong dung dịch nước có thể đánh giá được độ axit và độ kiềm của dung dịch. Nhưng dung dịch thường dùng có nồng độ H+ nhỏ, để tránh ghi nồng độ H+ với số mũ âm, người ta dùng giá trị pH.
- Giá trị pH có ý nghĩa to lớn trong thực tế.
+ pH của máu người và động vật có giá trị gần như không đổi.
+ Thực vật có thể sinh trưởng bình thường chỉ khi giá trị pH của dung dịch trong đất ở trong khoảng xác định đặc trưng cho mỗi loại cây.
+ Tốc độ ăn mòn kim loại trong nước tự nhiên phụ thuộc rất nhiều vào pH của nước mà kim loại tiếp xúc.
- Dung dịch axit dù loãng đến đâu thì pH<7.
- Dung dịch bazơ dù có loãng đến đâu thì pH>7.
3. Mở rộng tính pH trong dung dịch axit mạnh/bazơ mạnh
Nếu nồng độ của axit hoặc bazơ rất loãng ( ≤10-7) cần chú ý đến sự phân li của nước.
H2O <=> H+ + OH-
Ta có: [H+] .[ OH-] = 10-14

4. Bài tập minh họa tính pH trong dung dịch axit mạnh/bazơ mạnh
Bài 1: Tính pH của dung dịch HCl 0,01M?
A. 1
B. 2
C. 3
D. 4
Hướng dẫn
Phương trình điện li: HCl -> H+ + Cl-
=> [H+] = [HCl] = 0,01M
=> pH= -lg[H+] =2
Đáp án B
Bài 2: Tính pH của 200ml dung dịch Ba(OH)2 biết để trung hòa dung dịch trên cần 0,02 mol HCl?
A. 12
B. 13
C. 11
D. 10
Hướng dẫn
Phương trình :
Ba(OH)2 -> Ba2+ + 2OH-
HCl -> H+ + Cl-
OH- + H+ -> H2O
Ta có :
nOH- = nH+ = 0,02 mol
=> [ OH-] = 0,1M
=> pH = 14+ lg[OH-] =13
Đáp án B
Câu 3: pH của dung dịch HCl 10-7 M là:
A. 7,00
B. 6,50
C. 6,79
D. 6, 86
Hướng dẫn
Do nồng độ của axit rất loãng nên phải xét đến sự phân li của nước
Phương trình điện li:
HCl -> H+ + Cl-
H2O <=> H+ + OH-
Ta có:
[H+ ] = [Cl-] + [OH-] = 10-7 + 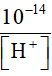
=> [H+] =1,62.10-7M
=> pH = -lg[H+] =6,79
Đáp án C
Xem thêm các Công thức Hóa học lớp 11 quan trọng hay khác:
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

