Công thức tính số mol OH- khi cho P2O5 tác dụng với dung dịch kiềm (hay, chi tiết)
Bài viết Công thức tính số mol OH- khi cho P2O5 tác dụng với dung dịch kiềm hay nhất, chi tiết với bài tập minh họa có lời giải sẽ giúp học sinh nắm vững Công thức tính số mol OH- khi cho P2O5 tác dụng với dung dịch kiềm từ đó biết cách làm bài tập về tính số mol OH- khi cho P2O5 tác dụng với dung dịch kiềm.
Công thức tính số mol OH- khi cho P2O5 tác dụng với dung dịch kiềm (hay, chi tiết)
Khi cho P2O5 tác dụng với dung dịch kiềm sẽ có những phản ứng nào xảy ra. Để giải chính xác dạng bài toán này ta cần nắm rõ các công thức nào? Bài viết dưới đây sẽ giúp các em hiểu rõ vấn đề này.
1. Công thức: tính số mol OH- khi cho P2O5 tác dụng với dung dịch kiềm
Dạng bài tập P2O5 tác dụng với dung dịch kiềm thực chất là axit H3PO4 tác dụng với dung dịch kiềm. Do P2O5 tác dụng với nước có trong dung dịch kiềm:
3H2O + P2O5 → 2H3PO4
Xét tỉ lệ T = 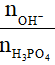
- Nếu T ≤ 1 thì tạo muối: H2PO4-
- Nếu 1 < T < 2 thì tạo 2 muối: H2PO4-và HPO42-
- Nếu T = 2 thì tạo muối: HPO42-
- Nếu 2 < T < 3 thì tạo 2 muối: HPO42-và PO43-
- Nếu T ≥ 3 thì tạo muối PO43-
*Nếu cả hai chất tham gia đều hết: nOH- = nH2O
*Nếu OH- dư: nOH- p/ư = nH2O = 3.nH3PO4
Ví dụ: Cho 21,30 gam P2O5 vào 440 gam dung dịch NaOH 10% thu được dung dịch X. Cô cạn dung dịch X thu được m gam chất rắn khan. Giá trị của m là
A. 50,60 gam. B. 57,20 gam C. 52,70 gam. D. 60,05 gam.
Hướng dẫn giải:
Ta có: = 0,15 mol → nH3PO4= 2.nP2O5= 0,3 mol.
Ta có nNaOH = 440.0,1 = 44 gam → nNaOH = 1,1 mol.
Xét T =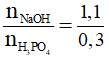 = 3,6667 > 3 → NaOH dư (phản ứng chỉ tạo muối Na3PO4)
= 3,6667 > 3 → NaOH dư (phản ứng chỉ tạo muối Na3PO4)
Phương trình hóa học: 3NaOH + H3PO4 → Na3PO4 + 3H2O
→ nH2O= 3nH3PO4= 0,9 mol
Áp dụng định luật bảo toàn khối lượng ta có:
mH3PO4 + mNaOH = mr + mH2O
→ mrắn = 0,3.98 + 44 – 0,9.18 = 57,2 gam
→ Chọn B
2. Bạn nên biết
Khi cho H3PO4 tác dụng với NaOH có thể xảy ra các phản ứng sau:
OH- + H3PO4 → H2PO4- + H2O
2OH- + H3PO4 → HPO42- + 2H2O
3OH + H3PO4 → PO43- + 3H2O
3. Kiến thức mở rộng tính số mol OH- khi cho P2O5 tác dụng với dung dịch kiềm
Áp dụng định luật bảo toàn khối lượng và bảo toàn nguyên tố để giải bài tập.
Định luật bảo toàn khối lượng: mH3PO4 + mNaOH = mr + mH2O
Định luật bảo toàn nguyên tố: nP = nH3PO4= 2.nP2O5; nNaOH (hoặc KOH) =nOH-

4. Bài tập minh họa tính số mol OH- khi cho P2O5 tác dụng với dung dịch kiềm
Câu 1: Cho m gam P2O5 tác dụng với 253,5 ml dung dịch NaOH 2M (dư), sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X. Cô cạn dung dịch X, thu được 3m gam chất rắn khan. Giá trị của m là
A. 6,886. B. 7,81. C. 8,52. D. 12,78.
Hướng dẫn giải:
Đặt nP2O5 = a → mP2O5= m = 142a (1)
Ta có nH3PO4 = 2.nP2O5= 2a → nNaOH phản ứng = 6a = nH2O
→ nNaOH bđ = 0,2535.2 mol
Áp dụng định luật bảo toàn khối lượng
mH3PO4 + mNaOH = mr + mH2O
→ 98.2a + 40.0,2535.2 = mr + 18.6a
→ 3m – 88a = 20,28 (2)
Từ (1) và (2) → m = 8,52 gam; a = 0,06 mol
→ Chọn C
Câu 2: Cho 200 ml dung dịch NaOH 1M tác dụng với 200 ml dung dịch H3PO4 0,5M, muối thu được có khối lượng là
A. 14,2 gam B. 15,8 gam C. 16,4 gam D. 11,9 gam
Hướng dẫn giải:
nNaOH = 0,2 mol; nH3PO4 = 0,1 mol
Xét T = 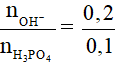 = 2 → hai chất phản ứng hết → Tạo một muối là Na2HPO4
= 2 → hai chất phản ứng hết → Tạo một muối là Na2HPO4
Áp dụng định luật bảo toàn nguyên tố P:
np = nNa2HPO4 = nH3PO4 =0,1 mol
→ mNa2HPO4= 142.0,1 = 14,2 gam
→ Chọn A
Xem thêm các Công thức Hóa học lớp 11 quan trọng hay khác:
Công thức tính số mol OH- ( hoặc CO2) khi cho CO2 tác dụng với dung dịch kiềm
Công thức tính % khối lượng các nguyên tố trong hợp chất hữu cơ
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

