Công thức phản ứng tráng gương (tráng bạc) của anđehit (hay, chi tiết)
Bài viết Công thức phản ứng tráng gương (tráng bạc) của anđehit hay nhất, chi tiết với bài tập minh họa có lời giải sẽ giúp học sinh nắm vững Công thức phản ứng tráng gương (tráng bạc) của anđehit từ đó biết cách làm bài tập về phản ứng tráng gương (tráng bạc) của anđehit.
Công thức phản ứng tráng gương (tráng bạc) của anđehit (hay, chi tiết)
Phản ứng tráng gương (tráng bạc) là phản ứng đặc trưng của anđehit. Tuy nhiên giải dạng bài toán này bằng cách viết phương trình và tính theo phương trình sẽ làm tốn nhiều thời gian. Vậy để giải nhanh các bài tập trắc nghiệm về phản ứng tráng gương (tráng bạc) của anđehit em cần ghi nhớ những công thức gì? Phản ứng này có những trường hợp gì đặc biệt? Các em hãy cùng theo dõi bài viết dưới đây.
1. Công thức phản ứng tráng gương (tráng bạc) của anđehit
- Đối với anđehit đơn chức R-CHO (R ≠ H)
R-CHO + 2AgNO3 + 3NH3 + H2O 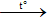
nAg = 2.n anđehit
→ n anđehit =
- Đặc biệt đối với HCHO phản ứng xảy ra như sau :
HCHO + 4AgNO3 + 6NH3 + 2H2O 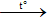
nAg = 4.nHCHO
→ nHCHO =
- Phản ứng tráng gương (tráng bạc) của của anđehit đa chức
R(CHO)x + 2xAgNO3 + 3xNH3 + xH2O 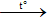
Trong đó: x là số nhóm chức -CHO của anđehit.
nAg = 2x.n anđehit
→ Số nhóm chức –CHO =
Ví dụ: Khối lượng Ag thu được khi cho 0,1 mol CH3CHO phản ứng hoàn toàn với lượng dư dung dịch AgNO3 trong NH3, đun nóng là
A. 21,6 gam. B. 43,2 gam. C. 16,2 gam. D. 10,8 gam.
Hướng dẫn giải:
Sơ đồ phản ứng:
nAg = 2.n anđehit = 2.0,1 = 0,2 mol
→ mAg = 0,2.108 = 21,6 gam.
→ Đáp án A
2. Bạn nên biết
- Nếu 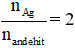
- Nếu 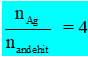
- Nếu hỗn hợp 2 anđehit mạch thẳng có
→ 1 anđehit là đơn chức và 1 anđehit là hai chức
Hoặc 1 anđehit đơn chức và 1 anđehit là HCHO
3. Kiến thức mở rộng phản ứng tráng gương (tráng bạc) của anđehit
Ngoài anđehit các hợp chất sau cũng có khả năng tham gia phản ứng tráng bạc:
+ HCOOH và muối hoặc ester của nó: HCOONa, HCOONH4, HCOOCH3,...
nAg = 2nHCOO-
+ Các hợp chất tạp chức có chứa nhóm chức -CHO: glucose, fructose,...
nAg = 2.n-CHO = 2n glucose (fructose)
4. Bài tập minh họa phản ứng tráng gương (tráng bạc) của anđehit
Câu 1: Cho 5,8 gam một anđehit X phản ứng hoàn toàn với lượng dư AgNO3 trong dung dịch NH3 thu được 21,6 gam Ag. Công thức cấu tạo thu gọn của anđehit X là
A. HCHO. B. OHC – CHO. C. CH3CHO. D. CH3CH2CHO.
Hướng dẫn giải:
Ta có: nAg = 0,2 mol
Nếu X là HCHO
→ n HCHO 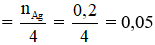
→ m HCHO = 0,05.30 = 1,5 gam ≠ 5,8 → không thỏa mãn.
Nếu X là anđehit đơn chức (R ≠ H)
→ nanđehit
Ta có:
→ X là C2H5CHO (thỏa mãn đáp án D)
Nếu X là anđehit hai chức:
Ta có: 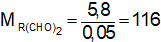
→ Đáp án D
Câu 2: Cho hỗn hợp gồm 0,1 mol CH3CHO và 0,2 mol HCHO tác dụng hết với dung dịch AgNO3/NH3 dư thì khối lượng Ag thu được là
A. 216,0 gam. B. 10,8 gam. C. 64,8 gam. D. 108,0 gam.
Hướng dẫn giải
→ mAg = 1.108 = 108 gam.
→ Đáp án D.
Câu 3: Cho 0,1 mol hỗn hợp X gồm 2 anđehit no, đơn chức, mạch hở kế tiếp nhau trong dãy đồng đẳng phản ứng hoàn toàn với lượng dư dung dịch AgNO3/NH3 thu được 32,4g Ag. Hai anđehit trong X là:
A. HCHO và C2H5CHO
B. HCHO và CH3CHO
C. CH3CHO và C2H5CHO
D. C2H3CHO và C3H5CHO
Hướng dẫn giải:
nAg = 0,3 mol
Xét
→ Hỗn hợp X phải có HCHO. Anđehit kế tiếp còn lại là CH3CHO
→ Đáp án B.
Xem thêm các Công thức Hóa học lớp 11 quan trọng hay khác:
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)

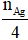
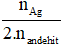
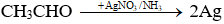
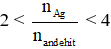

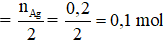
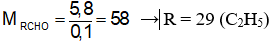
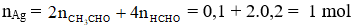
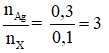



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

