Công thức tính hằng số phân li bazơ (hay, chi tiết)
Bài viết Công thức tính hằng số phân li bazơ hay nhất, chi tiết với bài tập minh họa có lời giải sẽ giúp học sinh nắm vững Công thức tính hằng số phân li bazơ từ đó biết cách làm bài tập về tính hằng số phân li bazơ.
Công thức tính hằng số phân li bazơ (hay, chi tiết)
Sự điện li của bazơ yếu trong nước là quá trình thuận nghịch. Vậy có đại lượng nào đánh giá lực của bazơ đó hay không? Để có câu trả lời, các em hãy tham khảo bài viết dưới đây.
1. Công thức tính hằng số phân li bazơ
Xét ví dụ: NH3 + H2O ⇄ NH4+ OH-
Hằng số phân li bazơ là:
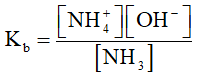
Vì nồng độ của nước coi như hằng số nên ta có thể bỏ qua nồng độ của nước.
2. Bạn nên biết
- Đối với bazơ nhiều nấc sẽ có nhiều hằng số phân li ở các nấc khác nhau.
- Hằng số phân li bazơ chỉ phụ thuộc vào bản chất bazơ và nhiệt độ.
- Nếu giá trị Kb càng nhỏ thì lực bazơ của nó càng yếu (hay tính bazơ càng yếu)
3. Mở rộng tính hằng số phân li bazơ
Mối liên hệ giữa hằng số Ka và Kb
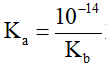 hay Ka.Kb =10-14
hay Ka.Kb =10-14

4. Bài tập minh họa tính hằng số phân li bazơ
Câu 1: Tính hằng số phân li bazơ của NH3 ở 25 ? Biết rằng ở 25 , 100ml dung dịch NH3 0,1Mcó pH = 11,12.
A. 2,76.10-4
B. 1,76.10-4
C. 2,76.10-5
D. 1,76.10-5
Hướng dẫn
Ta có:
[H+] = 10-11,12 => [OH-] = 10-2,88 M
NH3 + H2O ⇄ NH4+ + OH-
Bd 0,1
Pli 10-2,88 10-2,88 10-2,88
CH 0,1 - 10-2,88 10-2,88 10-2,88
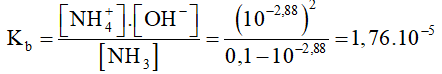
Đáp án D
Câu 2: Dung dịch CH3COONa 0,1M (Kb của CH3COO- = 5,71.10-10 ). pH của dung dịch là?
A. 8,878
B. 8,687
C. 8,478
D. 8,287
Hướng dẫn
Phương trình:
CH3COONa -> CH3COO- + Na+
CH3COO- + H2O ⇄ CH3COOH + OH-
Bd 0,1M
Pli x x x
CB 0,1- x x x (M)
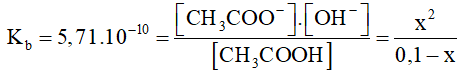
x << 0,1 => 0,1- x =0,1
=> 5,71.10-10= 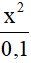
=> x= 7,556.10-6 M
=> pH = 14 + lgx = 8,878
Đáp án A
Câu 3: Tính nồng độ mol ion OH- có trong dung dịch NH3 0,1M, biết hằng số phân li bazơ Kb = 1,8.10-5 ?
A. 1,34.10-3
B. 2,34.10-3
C. 1,64.10-3
D. 2,64.10-3
Hướng dẫn
NH3 + H2O ⇄ NH4+ + OH-
Bd 0,1
Pli x x x
CB 0,1-x x x (M)
Vì x<<0,1 -> 0,1-x ≈ 0,1
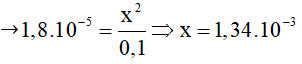
Vậy [OH-] = 1,34. 10-3 M
Đáp án A
Xem thêm các Công thức Hóa học lớp 11 quan trọng hay khác:
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

