Lý thuyết Liên kết cộng hóa trị (Hóa 10 Chân trời sáng tạo Bài 10)
Với tóm tắt lý thuyết Hóa học 10 Bài 10: Liên kết cộng hóa trị sách Chân trời sáng tạo hay nhất, chi tiết sẽ giúp học sinh lớp 10 nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa 10.
Lý thuyết Liên kết cộng hóa trị (Hóa 10 Chân trời sáng tạo Bài 10)
(199k) Xem Khóa học Hóa 10 CTST
I. Sự hình thành liên kết cộng hóa trị
1. Sự hình thành liên kết cộng hóa trị
- Liên kết cộng hóa trị là liên kết được hình thành giữa hai nguyên tử bằng một hay nhiều cặp electron chung.
- Liên kết cộng hóa trị được hình thành giữa các nguyên tử của cùng một nguyên tố hoặc giữa các nguyên tử của các nguyên tố không khác nhau nhiều về độ âm điện.
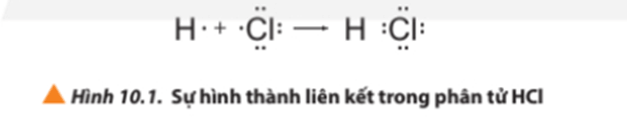
- Ví dụ 1: Sự hình thành liên kết cộng hóa trị trong phân tử hydrogen chloride
+ Giải thích: Nguyên tử H có 1 electron ở lớp ngoài cùng, nguyên tử Cl có 7 electron ở lớp ngoài cùng. Để đạt được cấu hình electron của khí hiếm gần nhất, mỗi nguyên tử này đều cần thêm 1 electron. Vì vậy, mỗi nguyên tử H và Cl cùng góp 1 electron để tạo nên 1 cặp electron chung cho cả 2 nguyên tử.
+ Cặp electron chung giữa 2 nguyên tử H và Cl được biểu diễn bằng 1 gạch nối “–”, đó là liên kết đơn. Do đó, liên kết trong phân tử HCl còn được biểu diễn là H – Cl.
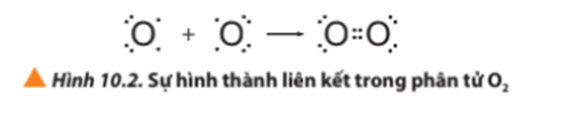
- Ví dụ 2: Sự hình thành liên kết cộng hóa trị trong phân tử oxygen
+ Giải thích: Mỗi nguyên tử O có 6 electron ở lớp ngoài cùng. Để đạt được cấu hình electron của khí hiếm gần nhất, mỗi nguyên tử này đều cần thêm 2 electron. Vì vậy, mỗi nguyên tử O cùng góp 2 electron để tạo nên 2 cặp electron chung cho cả 2 nguyên tử.
+ Hai cặp electron chung giữa 2 nguyên tử O được biểu diễn bằng hai gạch nối “=”, đó là liên kết đôi. Do đó, liên kết trong phân tử O2 còn được biểu diễn là O = O.
- Ví dụ 3: Sự hình thành liên kết cộng hóa trị trong phân tử nitrogen.
+ Giải thích: Mỗi nguyên tử N có 5 electron ở lớp ngoài cùng. Để đạt được cấu hình electron của khí hiếm gần nhất, mỗi nguyên tử này đều cần thêm 3 electron. Vì vậy, mỗi nguyên tử N cùng góp 3 electron để tạo nên 3 cặp electron chung cho cả 2 nguyên tử.
+ Ba cặp electron chung giữa 2 nguyên tử N được biểu diễn bằng ba gạch nối “≡”, đó là liên kết ba. Do đó, liên kết trong phân tử N2 còn được biểu diễn là N ≡ N.
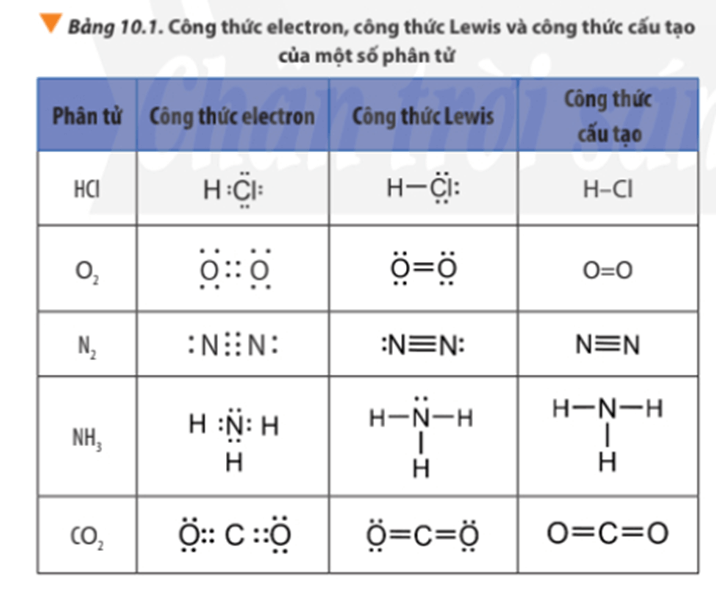
Chú ý: Các công thức H – Cl; O = O; N ≡ N gọi là công thức cấu tạo của HCl; O2; N2.
2. Tìm hiểu cách viết công thức Lewis
- Công thức Lewis biểu diễn sự hình thành liên kết hóa học giữa các nguyên tử trong một phân tử.
- Công thức Lewis của một phân tử được xây dựng từ công thức electron của phân tử, trong đó mỗi cặp electron chung giữa hai nguyên tử tham gia liên kết được thay bằng một gạch nối “–”.
II. Liên kết cho - nhận
- Liên kết cho – nhận là một trường hợp đặc biệt của liên kết cộng hóa trị, trong đó cặp electron chung chỉ do một nguyên tử đóng góp.
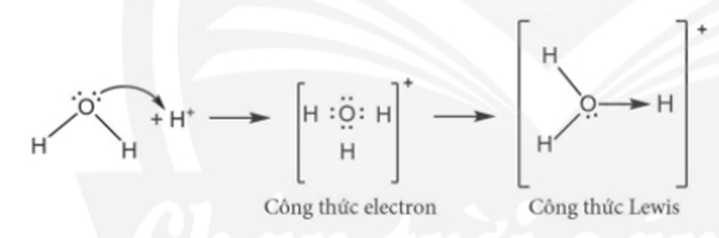
- Ví dụ: Sự tạo thành liên kết cho - nhận trong ion hydronium H3O+
Giải thích:
+ Trong phân tử H2O, nguyên tử O còn hai cặp electron chưa liên kết, ion H+ có AO trống, không chứa electron. Khi cho H2O kết hợp với ion H+, nguyên tử O sử dụng một cặp electron chưa liên kết làm cặp electron chung với ion H+ tạo thành ion H3O+.
+ Trong ion H3O+, nguyên tử oxygen đóng góp cặp electron chung nên là nguyên tử cho, ion H+ không đóng góp electron, đóng vai trò nhận electron.
+ Để biễu diễn liên kết cho - nhận, một mũi tên được hướng từ nguyên tử cho sang nguyên tử nhận để phân biệt với các liên kết còn lại.
III. Phân biệt các loại liên kết dựa theo độ âm điện
1. Phân biệt liên kết cộng hóa trị phân cực và không phân cực
- Liên kết cộng hóa trị không phân cực là liên kết cộng hóa trị trong đó cặp electron chung không lệch về phía nguyên tử nào.
Ví dụ: Liên kết cộng hóa trị trong các phân tử O2, N2 là liên kết cộng hóa trị không phân cực.
- Liên kết cộng hóa trị phân cực là liên kết cộng hóa trị trong đó cặp electron chung lệch về phía nguyên tử có độ âm điện lớn hơn.
Ví dụ: Liên kết cộng hóa trị trong các phân tử HCl, NH3 là liên kết cộng hóa trị phân cực.
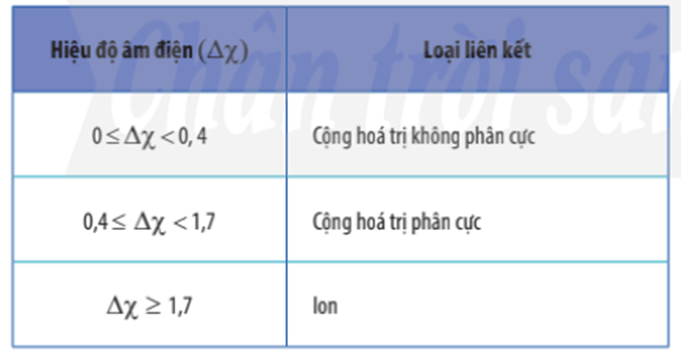
2. Phân biệt loại liên kết trong phân tử dựa trên giá trị hiệu độ âm điện
- Có thể dựa vào hiệu độ âm điện (∆χ) giữa hai nguyên tử tham gia liên kết để dự đoán loại liên kết giữa chúng.
- Ví dụ: Phân tử CH4 được cấu tạo nên tử nguyên tử C (độ âm điện 2,55) và nguyên tử H (độ âm điện 2,2).
Có hiệu độ âm điện (∆χ) = 2,55 – 2,2 = 0,35
Vậy liên kết giữa C và H trong phân tử CH4 là liên kết cộng hóa trị không phân cực.
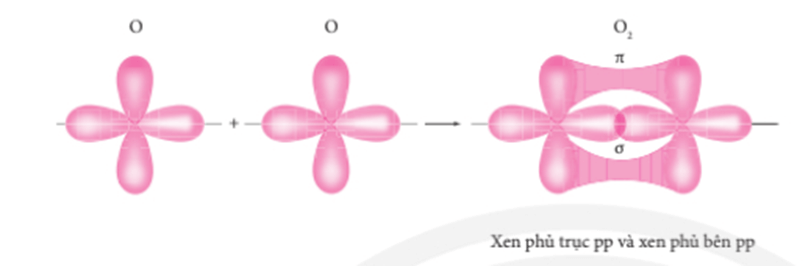
IV. Sự hình thành liên kết 𝛔, 𝛑 và năng lượng liên kết
1. Tìm hiểu sự hình thành liên kết 𝛔 và liên kết 𝛑
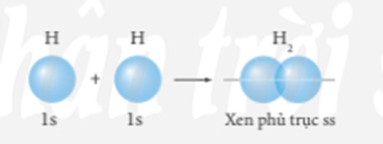
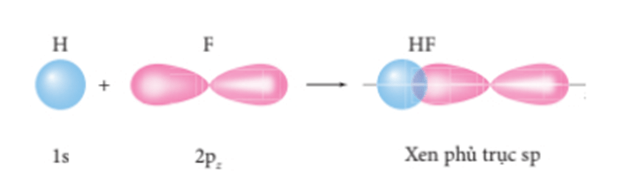
- Liên kết σ là loại liên kết cộng hóa trị được hình thành do sự xen phủ trục của hai orbital. Vùng xen phủ nằm trên đường nối tâm hai nguyên tử.
Ví dụ:
+ Sự xen phủ trục giữa 2 AO 1s của hai nguyên tử hydrogen hình thành liên kết σ trong phân tử H2.
+ Sự xen phủ giữa AO 1s của nguyên tử H và AO 2p của nguyên tử F hình thành liên kết σ trong phân tử HF.
- Liên kết π là loại liên kết cộng hóa trị được hình thành do sự xen phủ bên của hai orbital. Vùng xen phủ nằm hai bên đường nối tâm hai nguyên tử.
Ví dụ:
Sự xen phủ các AO hình thành liên kết σ và liên kết π trong phân tử oxygen.
2. Tìm hiểu khái niệm năng lượng liên kết
- Năng lượng liên kết của một liên kết hóa học là năng lượng cần thiết để phá vỡ 1 mol liên kết đó ở thể khí, tạo thành các nguyên tử ở thể khí.
- Giá trị năng lượng của một liên kết hóa học là thước đo độ bền liên kết. Năng lượng liên kết càng lớn thì liên kết càng bền và ngược lại.
Ví dụ:
Tổng năng lượng liên kết trong phân tử CH4 là 1660 kJ/ mol.
CH4 (g) → C(g) + 4H(g) Eb = 1660 kJ/ mol
Do đó, năng lượng liên kết trung bình của một liên kết C – H là:
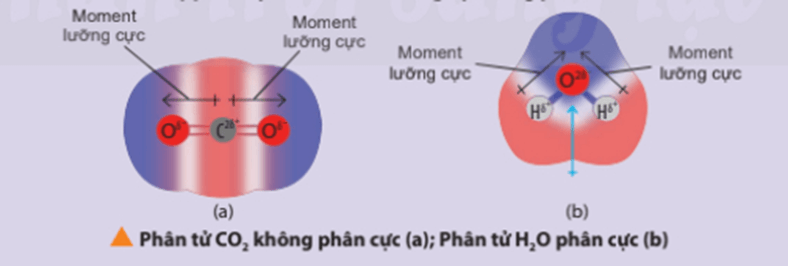
Chú ý: Nhận biết phân tử phân cực và phân tử không phân cực:
+ Phân tử phân cực là phân tử có tổng tất cả moment lưỡng cực trong phân tử khác không. Các phân tử phân cực thường tan tốt trong nước và các dung môi phân cực khác.
+ Phân tử không phân cực là phân tử có tổng tất cả các moment lưỡng cực trong phân tử bằng không. Phân tử không phân cực thường hòa tan tốt trong các dung môi không phân cực.
(199k) Xem Khóa học Hóa 10 CTST
Xem thêm tóm tắt lý thuyết Hóa học lớp 10 Chân trời sáng tạo hay khác:
Lý thuyết Hóa 10 Bài 11: Liên kết hydrogen và tương tác van der Waals
Lý thuyết Hóa 10 Bài 12: Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống
Lý thuyết Hóa 10 Bài 13: Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học
Lý thuyết Hóa 10 Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
Lý thuyết Hóa 10 Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
Xem thêm các tài liệu học tốt lớp 10 hay khác:
- Giải sgk Hóa học 10 Chân trời sáng tạo
- Giải Chuyên đề Hóa học 10 Chân trời sáng tạo
- Giải SBT Hóa học 10 Chân trời sáng tạo
- Giải lớp 10 Chân trời sáng tạo (các môn học)
- Giải lớp 10 Kết nối tri thức (các môn học)
- Giải lớp 10 Cánh diều (các môn học)
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 10 (hay nhất) - CTST
- Soạn văn 10 (ngắn nhất) - CTST
- Soạn văn 10 (siêu ngắn) - CTST
- Giải Toán 10 - CTST
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Giải sgk Vật lí 10 - CTST
- Giải sgk Hóa học 10 - CTST
- Giải sgk Sinh học 10 - CTST
- Giải sgk Địa lí 10 - CTST
- Giải sgk Lịch sử 10 - CTST
- Giải sgk Kinh tế và Pháp luật 10 - CTST
- Giải sgk Hoạt động trải nghiệm 10 - CTST

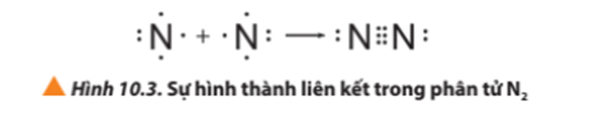



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

