Lý thuyết Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học (Hóa 10 Chân trời sáng tạo Bài 13)
Với tóm tắt lý thuyết Hóa học 10 Bài 13: Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học sách Chân trời sáng tạo hay nhất, chi tiết sẽ giúp học sinh lớp 10 nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa 10.
Lý thuyết Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học (Hóa 10 Chân trời sáng tạo Bài 13)
(199k) Xem Khóa học Hóa 10 CTST
I. Phản ứng tỏa nhiệt
- Phản ứng tỏa nhiệt là phản ứng có sự giải phóng nhiệt năng ra môi trường.
- Ví dụ:
Trong ngành đường sắt, phương pháp hàn nhiệt nhôm dùng để hàn đường ray. Hỗn hợp iron (III) oxide và bột nhôm được đốt cháy. Phản ứng nhiệt nhôm tỏa nhiệt rất lớn (trên 2500oC), làm nóng chảy hỗn hợp và sắt sinh ra từ phản ứng lấp đầy khe hở.
II. Phản ứng thu nhiệt
- Phản ứng thu nhiệt là phản ứng hóa học trong đó có sự hấp thụ nhiệt năng từ môi trường.
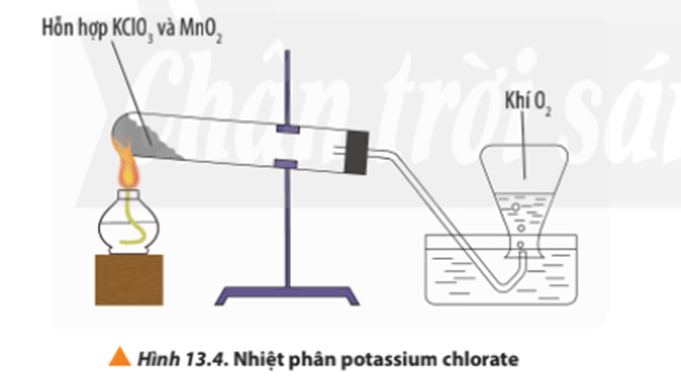
- Ví dụ: Phản ứng nhiệt phân potassium chlorate là phản ứng thu nhiệt:
2KClO3 (s) 3O2 (g) + 2KCl (s)
III. Biến thiên enthalpy chuẩn của phản ứng
1. Biến thiên enthalpy của phản ứng
- Biến thiên enthalpy của phản ứng (hay nhiệt phản ứng) được kí hiệu là ∆rH, thường tính theo đơn vị kJ hoặc kcal.
- Biến thiên enthalpy của phản ứng là nhiệt lượng tỏa ra hay thu vào của một phản ứng hóa học trong quá trình đẳng áp (áp suất không đổi).
- Biến thiên enthalpy chuẩn (hay nhiệt phản ứng chuẩn) của một phản ứng hóa học, được kí hiệu , là nhiệt kèm theo phản ứng đó trong điều kiện chuẩn.
- Chú ý: Điều kiện chuẩn: áp suất 1 bar (đối với chất khí), nồng độ 1 mol/ L (đối với chất tan trong dung dịch) và thường chọn nhiệt độ 25oC (hay 298K).
2. Phương trình nhiệt hóa học
- Phương trình nhiệt hóa học là phương trình phản ứng hóa học có kèm theo nhiệt phản ứng và trạng thái của các chất đầu (cđ) và sản phẩm (sp).
+ Ví dụ 1:
CH4 (g) + H2O (l) CO (g) + 3H2 (g)
+ Ví dụ 2:
2C2H5OH (l) + 3O2 (g) 2CO2 (g) + 3H2O (l)
- Chú ý:
+ Phản ứng thu nhiệt (hệ nhận nhiệt của môi trường) thì .
Như vậy phản ứng ở ví dụ 1 là phản ứng thu nhiệt.
+ Phản ứng tỏa nhiệt (hệ tỏa nhiệt ra môi trường) thì
Như vậy phản ứng ở ví dụ 2 là phản ứng tỏa nhiệt.
IV. Enthalpy tạo thành (nhiệt tạo thành)
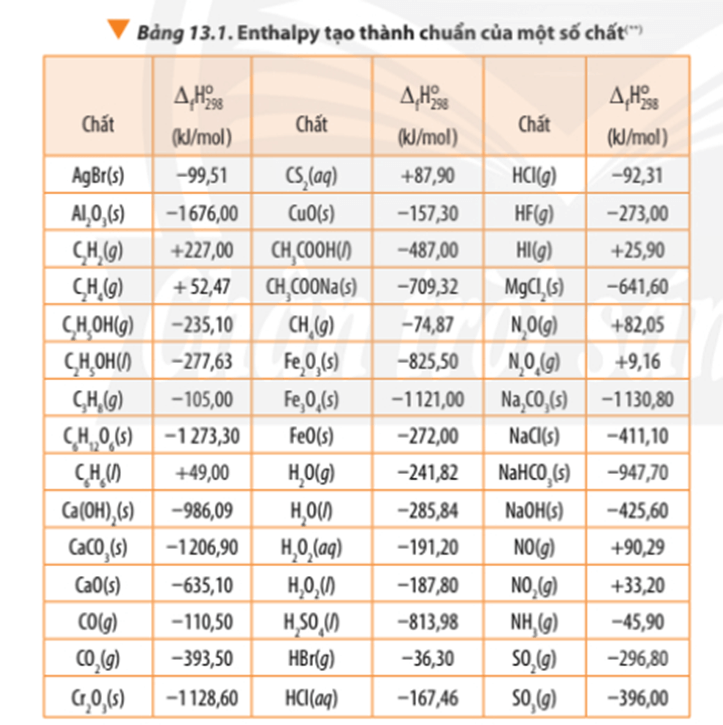
- Enthalpy tạo thành (hay nhiệt tạo thành) được kí hiệu bằng ∆fH, thường được tính theo đơn vị kJ/ mol hoặc kcal/ mol.
- Enthalpy tạo thành của một chất là nhiệt kèm theo phản ứng tạo thành 1 mol chất đó từ các đơn chất bền nhất.
- Enthalpy tạo thành trong điều kiện chuẩn được gọi là enthalpy tạo thành chuẩn (hay nhiệt tạo thành chuẩn) và được kí hiệu là .
Chú ý:
1. của đơn chất bền nhất bằng 0 (xét ở điều kiện chuẩn).
2. < 0, chất bền hơn về mặt năng lượng so với các đơn chất bền tạo nên nó.
3. > 0, chất kém bền hơn mặt năng lượng so với các đơn chất bền tạo nên nó.
V. Ý nghĩa của dấu và giá trị
- Phản ứng tỏa nhiệt:
- Phản ứng thu nhiệt:
- Thường các phản ứng có < 0 thì xảy ra thuận lợi.
Ví dụ:
Phản ứng nhiệt phân CaCO3
CaCO3 (s) → CaO (s) + CO2 (g)
Phản ứng có > 0 nên xảy ra không thuận lợi, thực tế phản ứng nung vôi cần cung cấp nhiệt liên tục, nếu dừng cung cấp nhiệt phản ứng sẽ không tiếp diễn.
(199k) Xem Khóa học Hóa 10 CTST
Xem thêm tóm tắt lý thuyết Hóa học lớp 10 Chân trời sáng tạo hay khác:
Lý thuyết Hóa 10 Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
Lý thuyết Hóa 10 Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
Lý thuyết Hóa 10 Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
Lý thuyết Hóa 10 Bài 17: Tính chất vật lí và hóa học các đơn chất nhóm VIIA
Lý thuyết Hóa 10 Bài 18: Hydrogen halide và một số phản ứng của ion halide
Xem thêm các tài liệu học tốt lớp 10 hay khác:
- Giải sgk Hóa học 10 Chân trời sáng tạo
- Giải Chuyên đề Hóa học 10 Chân trời sáng tạo
- Giải SBT Hóa học 10 Chân trời sáng tạo
- Giải lớp 10 Chân trời sáng tạo (các môn học)
- Giải lớp 10 Kết nối tri thức (các môn học)
- Giải lớp 10 Cánh diều (các môn học)
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 10 (hay nhất) - CTST
- Soạn văn 10 (ngắn nhất) - CTST
- Soạn văn 10 (siêu ngắn) - CTST
- Giải Toán 10 - CTST
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Giải sgk Vật lí 10 - CTST
- Giải sgk Hóa học 10 - CTST
- Giải sgk Sinh học 10 - CTST
- Giải sgk Địa lí 10 - CTST
- Giải sgk Lịch sử 10 - CTST
- Giải sgk Kinh tế và Pháp luật 10 - CTST
- Giải sgk Hoạt động trải nghiệm 10 - CTST





 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

