Lý thuyết Nguyên tố hóa học (Hóa 10 Chân trời sáng tạo Bài 3)
Với tóm tắt lý thuyết Hóa học 10 Bài 3: Nguyên tố hóa học sách Chân trời sáng tạo hay nhất, chi tiết sẽ giúp học sinh lớp 10 nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa 10.
Lý thuyết Nguyên tố hóa học (Hóa 10 Chân trời sáng tạo Bài 3)
(199k) Xem Khóa học Hóa 10 CTST
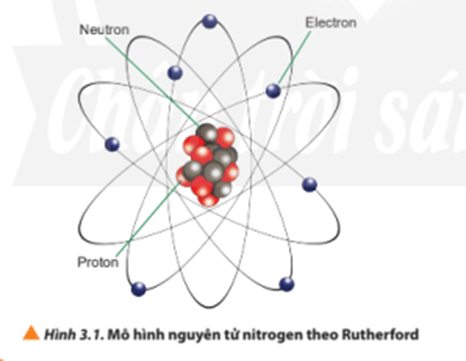
1. Hạt nhân nguyên tử
- Số đơn vị điện tích hạt nhân (Z) = số proton (P) = số electron (E).
- Điện tích hạt nhân = + Z.
- Số khối (A) = số proton (P) + số neutron (N)
Ví dụ: Nguyên tử sodium có 11 proton, 12 neutron. Suy ra:
+ Nguyên tử sodium có số đơn vị điện tích hạt nhân = số proton = số electron = 11.
+ Điện tích hạt nhân nguyên tử sodium là +11.
+ Số khối A = 11 + 12 = 23.
II. Nguyên tố hóa học
1. Số hiệu nguyên tử
- Số hiệu nguyên tử của một nguyên tố được quy ước bằng số đơn vị điện tích hạt nhân nguyên tử của nguyên tố đó.
- Số hiệu nguyên tử (kí hiệu là Z) cho biết:
+ Số proton trong hạt nhân nguyên tử.
+ Số electron trong nguyên tử.
- Mỗi nguyên tố hóa học có một số hiệu nguyên tử.
2. Nguyên tố hóa học
- Nguyên tố hóa học là tập hợp những nguyên tử có cùng điện tích hạt nhân.
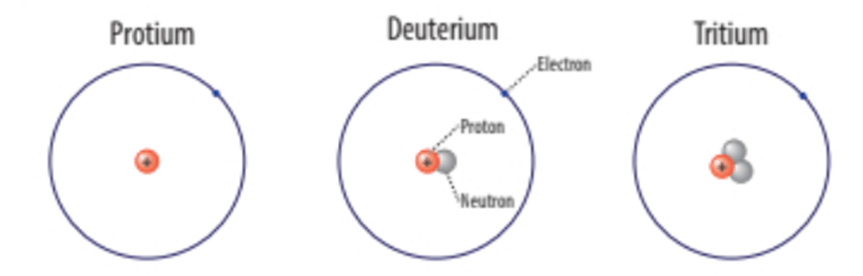
Ví dụ: Protium; deuterium và tritium là các loại nguyên tử của nguyên tố hydrogen.
3. Kí hiệu nguyên tử
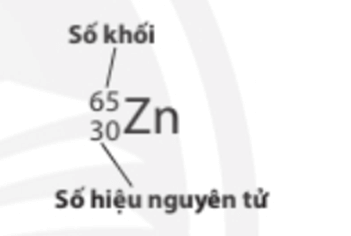
- Số đơn vị điện tích hạt nhân nguyên tử (số hiệu nguyên tử) của một nguyên tố hóa học và số khối được xem là những đặc trưng cơ bản của nguyên tử.
- Để kí hiệu nguyên tử, người ta thường ghi các chỉ số đặc trưng ở bên trái kí hiệu nguyên tố với số khối A ở phía trên, số hiệu nguyên tử Z ở phía dưới.
Ví dụ:
III. Đồng vị
- Các đồng vị của một nguyên tố hóa học là những nguyên tử có cùng số proton (P), cùng số hiệu nguyên tử (Z), nhưng khác nhau về số neutron (N). Do đó, số khối (A) của chúng khác nhau.
- Ví dụ: Hydrogen có 3 đồng vị là:
- Ngoài các đồng vị bền, các nguyên tố hóa học còn có một số đồng vị không bền, gọi là các đồng vị phóng xạ, được sử dụng nhiều trong đời sống, y học, nghiên cứu khoa học…
IV. Nguyên tử khối và nguyên tử khối trung bình
1. Nguyên tử khối
- Nguyên tử khối là khối lượng tương đối của nguyên tử.
- Nguyên tử khối của một nguyên tử cho biết khối lượng của nguyên tử đó nặng gấp bao nhiêu lần đơn vị khối lượng nguyên tử (1 amu).
- Một cách gần đúng, coi nguyên tử khối có giá trị bằng số khối.
2. Nguyên tử khối trung bình
- Mỗi nguyên tố thường có nhiều đồng vị, do đó trong thực tế người ta thường sử dụng giá trị nguyên tử khối trung bình.
- Muốn xác định giá trị nguyên tử khối trung bình của một nguyên tố, ta cần phải biết được phần trăm số nguyên tử các đồng vị của nguyên tố đó trong tự nhiên. Người ta thường dùng phương pháp phổ khối lượng để xác định phần trăm số nguyên tử các đồng vị tự nhiên của các nguyên tố.
- Công thức tính nguyên tử khối trung bình của nguyên tố X:
Trong đó:
: là nguyên tử khối trung bình của X
Ai: là nguyên tử khối đồng vị thứ i
ai: là tỉ lệ % số nguyên tử đồng vị thứ i.
Ví dụ:
Trong tự nhiên, chlorine có hai đồng vị là 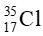
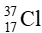
(199k) Xem Khóa học Hóa 10 CTST
Xem thêm tóm tắt lý thuyết Hóa học lớp 10 Chân trời sáng tạo hay khác:
Lý thuyết Hóa 10 Bài 4: Cấu trúc lớp vỏ electron của nguyên tử
Lý thuyết Hóa 10 Bài 5: Cấu tạo bảng tuần hoàn các nguyên tố hóa học
Lý thuyết Hóa 10 Bài 7: Định luật tuần hoàn – Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Xem thêm các tài liệu học tốt lớp 10 hay khác:
- Giải sgk Hóa học 10 Chân trời sáng tạo
- Giải Chuyên đề Hóa học 10 Chân trời sáng tạo
- Giải SBT Hóa học 10 Chân trời sáng tạo
- Giải lớp 10 Chân trời sáng tạo (các môn học)
- Giải lớp 10 Kết nối tri thức (các môn học)
- Giải lớp 10 Cánh diều (các môn học)
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 10 (hay nhất) - CTST
- Soạn văn 10 (ngắn nhất) - CTST
- Soạn văn 10 (siêu ngắn) - CTST
- Giải Toán 10 - CTST
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Giải sgk Vật lí 10 - CTST
- Giải sgk Hóa học 10 - CTST
- Giải sgk Sinh học 10 - CTST
- Giải sgk Địa lí 10 - CTST
- Giải sgk Lịch sử 10 - CTST
- Giải sgk Kinh tế và Pháp luật 10 - CTST
- Giải sgk Hoạt động trải nghiệm 10 - CTST

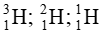



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

