Lý thuyết Quy tắc octet (Hóa 10 Chân trời sáng tạo Bài 8)
Với tóm tắt lý thuyết Hóa học 10 Bài 8: Quy tắc octet sách Chân trời sáng tạo hay nhất, chi tiết sẽ giúp học sinh lớp 10 nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa 10.
Lý thuyết Quy tắc octet (Hóa 10 Chân trời sáng tạo Bài 8)
(199k) Xem Khóa học Hóa 10 CTST
I. Liên kết hóa học
- Phân tử được tạo nên từ các nguyên tử bằng liên kết hóa học.
II. Quy tắc octet
- Quy tắc octet (bát tử): Trong quá trình hình thành liên kết hóa học, nguyên tử của các nguyên tố nhóm A có xu hướng tạo thành lớp vỏ ngoài cùng có 8 electron tương ứng với khí hiếm gần nhất (hoặc 2 electron với khí hiếm helium).
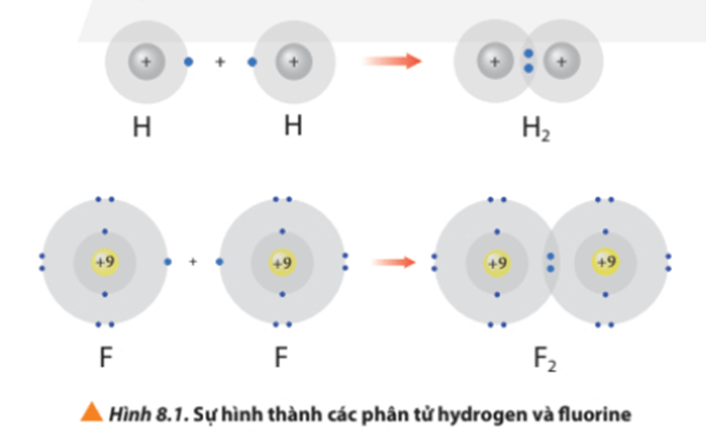
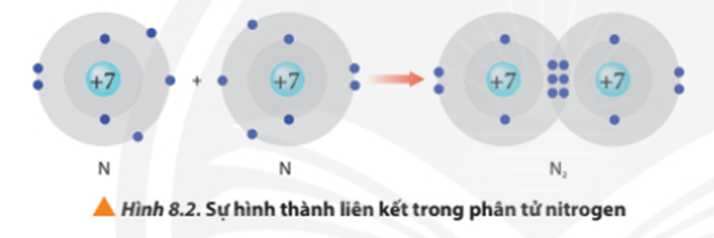
- Ví dụ 1: Vận dụng quy tắc octet trong sự hình thành phân tử nitrogen (N2)
Liên kết giữa 2 nguyên tử nitrogen (N) trong phân tử nitrogen (N2) được tạo thành do mỗi nguyên tử N đã góp chung 3 electron hóa trị, tạo nên 3 cặp electron chung.
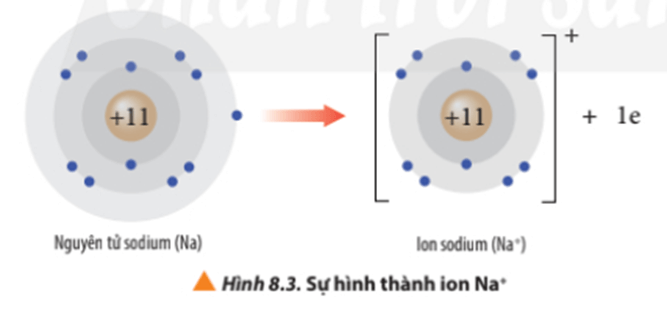
- Ví dụ 2: Vận dụng quy tắc octet trong sự tạo thành ion sodium (Na+).
Nguyên tử sodium có 1 electron ở lớp ngoài cùng. Nếu mất đi 1 electron nguyên tử sodium sẽ đạt được cấu hình electron bền vững, giống với khí hiếm gần nhất là Ne.
Viết gọn: Na → Na+ + 1e
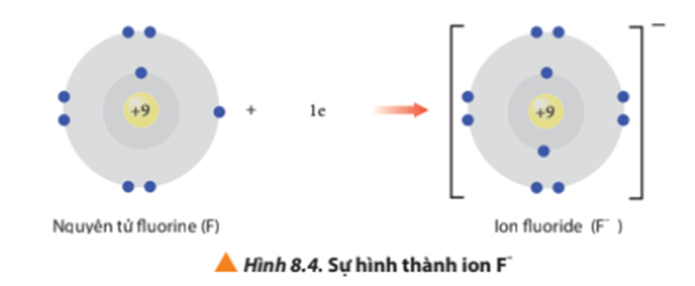
Ví dụ 3: Vận dụng quy tắc octet trong sự tạo thành ion fluorine
Nguyên tử fluorine có 7 electron ở lớp ngoài cùng. Khi nhận vào 1 electron nguyên tử Fluorine sẽ đạt được cấu hình electron bền vững giống khí hiếm Ne.
Viết gọn: F + 1e → F-
Chú ý:
+ Không phải mọi trường hợp, nguyên tử của các nguyên tố khi tham gia liên kết đều tuân theo quy tắc octet. Người ta nhận thấy, một số phân tử có thể không tuân theo quy tắc octet như: NO; BH3; SF6 …
+ Với nguyên tử của các nguyên tố nhóm B, người ta áp dụng một số quy tắc khác, tương ứng với quy tắc octet, là quy tắc 18 electron để giải thích xu hướng khi tham gia liên kết hóa học của chúng.
(199k) Xem Khóa học Hóa 10 CTST
Xem thêm tóm tắt lý thuyết Hóa học lớp 10 Chân trời sáng tạo hay khác:
Lý thuyết Hóa 10 Bài 11: Liên kết hydrogen và tương tác van der Waals
Lý thuyết Hóa 10 Bài 12: Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống
Lý thuyết Hóa 10 Bài 13: Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học
Xem thêm các tài liệu học tốt lớp 10 hay khác:
- Giải sgk Hóa học 10 Chân trời sáng tạo
- Giải Chuyên đề Hóa học 10 Chân trời sáng tạo
- Giải SBT Hóa học 10 Chân trời sáng tạo
- Giải lớp 10 Chân trời sáng tạo (các môn học)
- Giải lớp 10 Kết nối tri thức (các môn học)
- Giải lớp 10 Cánh diều (các môn học)
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 10 (hay nhất) - CTST
- Soạn văn 10 (ngắn nhất) - CTST
- Soạn văn 10 (siêu ngắn) - CTST
- Giải Toán 10 - CTST
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Giải sgk Vật lí 10 - CTST
- Giải sgk Hóa học 10 - CTST
- Giải sgk Sinh học 10 - CTST
- Giải sgk Địa lí 10 - CTST
- Giải sgk Lịch sử 10 - CTST
- Giải sgk Kinh tế và Pháp luật 10 - CTST
- Giải sgk Hoạt động trải nghiệm 10 - CTST




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

