Lý thuyết Ammonia và một số hợp chất ammonium (Hóa 11 Chân trời sáng tạo Bài 4)
Với tóm tắt lý thuyết Hóa 11 Bài 4: Ammonia và một số hợp chất ammonium sách Chân trời sáng tạo hay nhất, chi tiết sẽ giúp học sinh lớp 11 nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 11.
Lý thuyết Ammonia và một số hợp chất ammonium (Hóa 11 Chân trời sáng tạo Bài 4)
(199k) Xem Khóa học Hóa 11 CTST
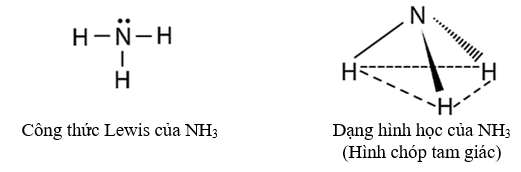
1. Cấu tạo phân tử của ammonia
Phân tử NH3 có cấu trúc chóp tam giác, với nguyên tử nitrogen ở đỉnh, đáy là một tam giác mà đỉnh là 3 nguyên tử hydrogen.
2. Tính chất của ammonia
a. Tính chất vật lí
Ammonia là chất khí không màu, mùi khai và xốc, nhẹ hơn không khí. Ammonia tan rất nhiều trong nước tạo thành dung dịch ammonia. Dung dịch ammonia đậm đặc thường có nồng độ 25%.
b. Tính chất hoá học
Ammonia chủ yếu thể hiện tính khử và tính base trong các phản ứng hoá học.
- Ammonia thể hiện tính base:
NH3 + HCl → NH4Cl
2NH3 + H2SO4 → (NH4)2SO4
- Ammonia thể hiện tính khử:
3. Tổng hợp ammonia
Quá trình Haber được thể hiện như sau:
- Hỗn hợp nitrogen và hydrogen (tỉ lệ mol 1 : 3) được nén ở áp suất cao và đưa vào tháp tổng hợp ammonia trong điều kiện nhiệt độ, áp suất và chất xúc tác thích hợp.
- Hỗn hợp khí đi ra từ tháp tổng hợp gồm N2, H2 và NH3 được dẫn đến tháp làm lạnh. Ở đây, NH3 hoá lỏng và được tách riêng, còn hỗn hợp khí N2 và H2 chưa phản ứng được đưa trở lại tháp tổng hợp.
4. Muối ammonium
a. Tính chất vật lí
Muối ammonium là những chất tinh thể ion. Hầu hết các muối ammonium dễ tan trong nước.
b. Tính chất hoá học
- Muối ammonium tác dụng với dung dịch kiềm khi đun nóng cho khi ammonia có mùi xốc đặc trưng. Phản ứng này dùng để nhận biết ion ammonium trong dung dịch.
- Muối ammonium dễ bị phân huỷ khi đun nóng.
5. Ứng dụng
- Ammonia được sử dụng để sản xuất nitric acid, các loại phân đạm. Ammonia còn được sử dụng làm chất làm lạnh, làm dung môi và nhiều ứng dụng quan trọng khác trong đời sống và sản xuất.
- Muối ammonium được sử dụng rộng rãi trong đời sống và sản xuất, đặc biệt được dùng làm phân bón trong nông nghiệp.
(199k) Xem Khóa học Hóa 11 CTST
Xem thêm tóm tắt lý thuyết Hóa học lớp 11 Chân trời sáng tạo hay khác:
Lý thuyết Hoá 11 Bài 5: Một số hợp chất với oxygen của nitrogen
Lý thuyết Hoá 11 Bài 9: Phương pháp tách và tinh chế hợp chất hữu cơ
Xem thêm các tài liệu học tốt lớp 11 hay khác:
- Giải sgk Hóa học 11 Chân trời sáng tạo
- Giải Chuyên đề học tập Hóa 11 Chân trời sáng tạo
- Giải SBT Hóa học 11 Chân trời sáng tạo
- Giải lớp 11 Chân trời sáng tạo (các môn học)
- Giải lớp 11 Kết nối tri thức (các môn học)
- Giải lớp 11 Cánh diều (các môn học)
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 11 (hay nhất) - CTST
- Soạn văn 11 (ngắn nhất) - CTST
- Giải sgk Toán 11 - CTST
- Giải Tiếng Anh 11 Global Success
- Giải sgk Tiếng Anh 11 Smart World
- Giải sgk Tiếng Anh 11 Friends Global
- Giải sgk Vật Lí 11 - CTST
- Giải sgk Hóa học 11 - CTST
- Giải sgk Sinh học 11 - CTST
- Giải sgk Lịch Sử 11 - CTST
- Giải sgk Địa Lí 11 - CTST
- Giải sgk Giáo dục KTPL 11 - CTST
- Giải sgk Hoạt động trải nghiệm 11 - CTST
- Giải sgk Âm nhạc 11 - CTST

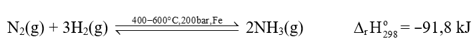



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

