Lý thuyết Sulfuric acid và muối sulfate (Hóa 11 Chân trời sáng tạo Bài 7)
Với tóm tắt lý thuyết Hóa 11 Bài 7: Sulfuric acid và muối sulfate sách Chân trời sáng tạo hay nhất, chi tiết sẽ giúp học sinh lớp 11 nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 11.
Lý thuyết Sulfuric acid và muối sulfate (Hóa 11 Chân trời sáng tạo Bài 7)
(199k) Xem Khóa học Hóa 11 CTST
1. Sulfuric acid
- Tính chất vật lí: Sulfur acid là chất lỏng sánh như dầu, không màu, không bay hơi, nặng gần gấp hai lần nước (98% có khối lượng riêng là 1,84 g/cm3).
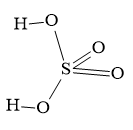
- Cấu tạo phân tử:
- Tính chất hoá học:
+ Dung dịch sulfuric acid loãng là một trong các acid mạnh và có tính chất chung của acid như làm quỳ tím hoá đỏ, tác dụng với kim loại, base, muối,…
+ Dung dịch sulfuric acid đặc có tính oxi hoá mạnh và tính háo nước.
Cu + H2SO4 (đặc) CuSO4 + SO2 + H2O
C12H22O11 + H2SO4 (đặc) → 12C + H2SO4.11H2O
(Saccharose)
C + 2H2SO4 (đặc) → CO2 + 2SO2 + 2H2O
+ Sulfuric acid là hoá chất hàng đầu được dùng trong nhiều ngành sản xuất: Sản xuất phân bón, thuốc trừ sâu, chất tẩy rửa tổng hợp, tơ sợi hoá học, chất dẻo, sơn màu,…
- Cách bảo quản, sử dụng và nguyên tắc xử lí sơ bộ khi bỏng acid
+ Khi sử dụng, bảo quản dung dịch sulfuric acid cần phải cẩn thận, tuân thử đúng nguyên tắc an toàn.
Cần bảo quản sulfuric acid trong các bình kín và đặt ở nơi khô ráo, thoáng mát; không đặt gần nơi có các chất khử, kim loại nhẹ.
Pha loãng dung dịch H2SO4 đặc: Rót từ từ dung dịch H2SO4 đặc vào nước và khuấy đều. Tuyệt đối không làm ngược lại, sẽ rất nguy hiểm.
+ Cần nắm vững và thực hiện đúng các nguyên tắc xử lí sơ bộ khi bị bỏng acid: Khi bị bỏng aicd, cần nhanh chóng bỏ quần áo bị dính acid, sau đó rửa ngay bằng nước sạch khoảng 20 phút. Sau đó, cần nhanh chóng chuyển người bị bỏng đến cơ sở y tế gần nhất để được theo dõi và điều trị.
- Quy trình sản xuất sulfuric acid theo phương pháp tiếp xúc:
Giai đoạn 1: Sản xuất sulfur dioxide (SO2)
4FeS2 + 11O2 2Fe2O3 + 8SO2
S + O2 SO2
Giai đoạn 2: Sản xuất sulfur trioxide (SO3)
Giai đoạn 3: Sản xuất sulfuric acid (H2SO4)
H2SO4 + nSO3 → H2SO4.nSO3 (Oleum)
H2SO4.nSO3 + nH2O → (n+1)H2SO4
2. Muối sulfate
- Muối sulfate là những hợp chất quan trọng, được ứng dụng trong nhiều ngành công nghiệp. Ví dụ: CaSO4 làm vật liệu xây dựng, làm chất phụ gia; MgSO4 được sử dụng sản xuất muối tắm, (NH4)2SO4 là thành phần của thuốc trừ sâu hoà tan, thuốc diệt nấm,…
- Thuốc thử để nhận biết ion sulfate (trong dung dịch H2SO4 hoặc trong dung dịch muối sulfate) là ion (trong dung dịch barium hoặc dung dịch Ba(OH)2).
(trắng)
(199k) Xem Khóa học Hóa 11 CTST
Xem thêm tóm tắt lý thuyết Hóa học lớp 11 Chân trời sáng tạo hay khác:
Xem thêm các tài liệu học tốt lớp 11 hay khác:
- Giải sgk Hóa học 11 Chân trời sáng tạo
- Giải Chuyên đề học tập Hóa 11 Chân trời sáng tạo
- Giải SBT Hóa học 11 Chân trời sáng tạo
- Giải lớp 11 Chân trời sáng tạo (các môn học)
- Giải lớp 11 Kết nối tri thức (các môn học)
- Giải lớp 11 Cánh diều (các môn học)
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 11 (hay nhất) - CTST
- Soạn văn 11 (ngắn nhất) - CTST
- Giải sgk Toán 11 - CTST
- Giải Tiếng Anh 11 Global Success
- Giải sgk Tiếng Anh 11 Smart World
- Giải sgk Tiếng Anh 11 Friends Global
- Giải sgk Vật Lí 11 - CTST
- Giải sgk Hóa học 11 - CTST
- Giải sgk Sinh học 11 - CTST
- Giải sgk Lịch Sử 11 - CTST
- Giải sgk Địa Lí 11 - CTST
- Giải sgk Giáo dục KTPL 11 - CTST
- Giải sgk Hoạt động trải nghiệm 11 - CTST
- Giải sgk Âm nhạc 11 - CTST




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

