Lý thuyết Nguồn điện hoá học (Hóa 12 Cánh diều Bài 11)
Với tóm tắt lý thuyết Hóa 12 Bài 11: Nguồn điện hoá học sách Cánh diều hay nhất, chi tiết sẽ giúp học sinh lớp 12 nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 12.
Lý thuyết Nguồn điện hoá học (Hóa 12 Cánh diều Bài 11)
I. CẤU TẠO VÀ NGUYÊN TẮC HOẠT ĐỘNG CỦA PIN GALVANI
Phản ứng xảy ra trong pin điện hoá là phản ứng oxi hoá – khử gián tiếp (tức là electron không chuyển trực tiếp từ chất khử sang chất oxi hoá), năng lượng của phản ứng hoá học lúc này được giải phóng dưới dạng điện năng.
1. Cấu tạo
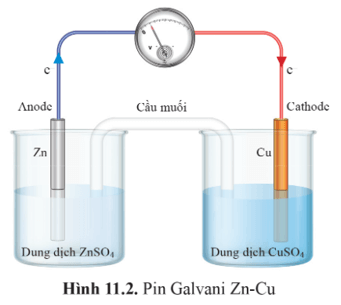
- Một pin Galvani được tạo nên từ hai cặp oxi hoá - khử khác nhau (ví dụ Cu²+/Cu và Zn2+/Zn, gọi là pin Galvani Zn – Cu). Trong đó, kim loại mạnh hơn đóng vai trò anode (điện cực âm của pin), kim loại yếu hơn đóng vai trò cathode (điện cực dương của pin).
- Hai dung dịch muối trong pin Galvani được nối với nhau bởi một cầu muối. Cầu muối có vai trò trung hoà điện tích mỗi dung dịch trong pin, duy trì dòng điện trong quá trình hoạt động của pin điện hoá.
Chú ý: Trong pin điện hoá, anode là điện cực âm, nơi xảy ra quá trình oxi hoá (quá trình nhường electron); cathode là điện cực dương, nơi xảy ra quá trình khử (quá trình nhận electron).
2. Nguyên tắc hoạt động
- Nguyên tắc hoạt động của pin Galvani dựa trên phản ứng oxi hóa – khử tự diễn biến, trong đó electron chuyển từ cực âm sang cực dương thông qua một dây dẫn điện.
- Phản ứng hoá học diễn ra trong pin kèm theo sự giải phóng năng lượng dưới dạng điện năng.
- Ví dụ:
|
Pin Galvani Zn-Cu |
|
|
Anode (Zn) |
Cathode (Cu) |
|
Zn nhường electron, chuyển thành ion Zn2+ tan vào dung dịch. |
Ion Cu2+ trong dung dịch nhận electron (từ điện cực Zn qua dây dẫn chuyển sang điện cực Cu) chuyển thành Cu bám lên điện cực Cu |
|
Phản ứng diễn ra trong pin là: Zn(s) + Cu²+(aq) → Zn2+(aq) + Cu(s) |
|
3. Sức điện động của pin điện hoá
- Sức điện động chuẩn của pin tạo từ hai cặp oxi hoá – khử Xm+/X và Yn⁺/Y (trong đó ) được tính theo công thức sau:
- Ví dụ cho biết thế điện cực chuẩn của cặp và sức điện động chuẩn của pin Zn – Cu là:
II. Thực hành lắp một số pin đơn giản
- Trong thực tế, có thể tạo ra dòng điện hoá học dựa trên nguyên tắc hoạt động của pin Galvani một cách đơn giản: Pin tạo bởi hai điện cực kim loại khác nhau tiếp xúc với cùng một dung dịch chất điện li.
* Chuẩn bị:
- Hoá chất: Hai thanh (hoặc dây) kim loại khác nhau (ví dụ đồng, kẽm,...), dung dịch chất điện li (ví dụ dung dịch HCl, H2SO4 loãng, NaCl,... hoặc quả chanh, quả táo,...).
- Dụng cụ: Vôn kế (hoặc đèn led nhỏ để nhận biết sự xuất hiện của dòng điện), dây dẫn, cốc thuỷ tinh.
* Tiến hành:
- Cắm hai thanh (hoặc dây) kim loại vào cốc chứa dung dịch chất điện li (hoặc quả chanh, quả táo...).
- Đo sức điện động giữa hai thanh (hoặc dây) kim loại bằng vôn kế.
Chú ý: Alessandro Volta (1745-1827, nhà bác học người Italia, hình dưới) là người đầu tiên chế tạo được pin điện từ tấm đồng và tấm kẽm cùng nhúng trong dung dịch muối ăn, do vậy loại pin này còn được gọi là pin Volta.
III. GIỚI THIỆU MỘT SỐ LOẠI PIN THÔNG DỤNG KHÁC
|
Pin |
Ưu điểm |
Nhược điểm |
|
Acquy chì |
- Dễ sản xuất, giá thành thấp. - Hoạt động ổn định. - Dễ thu hồi sulfuric acid và chì để tái chế. |
- Nặng, tuổi thọ thấp (trung bình khoảng 1 năm). - Gây ô nhiễm môi trường và ngộ độc chì ở các làng nghề tái chế acquy cũ. |
|
Pin nhiên liệu |
- Điều chỉnh được cường độ dòng điện nhờ thay đổi tốc độ dòng nhiên liệu. - Hiệu suất chuyển đổi năng lượng cao, lượng chất phát thải ít và dễ kiểm soát. |
- Giá thành cao. |
|
Pin Mặt Trời |
- Là nguồn năng lượng sạch, không phát thải khí gây ô nhiễm môi trường. - Tận dụng được năng lượng vô tận của Mặt Trời. |
- Sản xuất khá phức tạp, giá thành cao. - Cần nhiều ánh nắng nên phụ thuộc vào khí hậu, thời tiết. - Các tấm pin Mặt Trời hết hạn sử dụng có nguy cơ gây ô nhiễm môi trường. |
|
Pin lithium - ion |
- Nhẹ, nhỏ gọn, bền, mật độ năng lượng cao. - Sạc nhanh và có thể sạc mọi thời điểm. |
- Giá thành cao, dễ hư hỏng bởi nhiệt. - Tiềm ẩn nguy cơ cháy nổ. |
|
Pin khô |
- Năng lượng ổn định, giá rẻ, phù hợp các thiết bị di động. |
- Điện áp thấp, tiềm ẩn nguy cơ ô nhiễm môi trường. |
Xem thêm tóm tắt lý thuyết Hóa học lớp 12 Cánh diều hay khác:
Xem thêm các tài liệu học tốt lớp 12 hay khác:
- Giải sgk Hóa học 12 Cánh diều
- Giải Chuyên đề học tập Hóa 12 Cánh diều
- Giải SBT Hóa học 12 Cánh diều
- Giải lớp 12 Cánh diều (các môn học)
- Giải lớp 12 Kết nối tri thức (các môn học)
- Giải lớp 12 Chân trời sáng tạo (các môn học)
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều





 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

