Lý thuyết Nước cứng và làm mềm nước cứng (Hóa 12 Cánh diều Bài 19)
Với tóm tắt lý thuyết Hóa 12 Bài 19: Nước cứng và làm mềm nước cứng sách Cánh diều hay nhất, chi tiết sẽ giúp học sinh lớp 12 nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 12.
Lý thuyết Nước cứng và làm mềm nước cứng (Hóa 12 Cánh diều Bài 19)
I. NƯỚC CỨNG
1. Khái niệm
Nước cứng là nước chứa nhiều cation Ca2+ và Mg2+. Nước chứa ít hoặc không chứa cation Ca2+ và Mg2+ được gọi là nước mềm.
Chú ý: Khi nước ngầm, nước mặt chảy qua các vùng đất có khoáng vật calcite (đá vôi), gypsum (thạch cao), apatite,... ; sẽ hoà tan nhiều hợp chất của calcium, magnesium và trở thành nước cứng.
2. Phân loại
Căn cứ vào thành phần anion gốc acid trong nước, nước cứng được chia thành ba loại:
- Tính cứng tạm thời là tính cứng gây nên bởi các muối Ca(HCO3)2 và Mg(HCO3)2.
- Tính cứng vĩnh cửu là tính cứng gây nên bởi các muối sulfate, chloride của calcium và magnesium.
- Tính cứng toàn phần gồm tính cứng tạm thời và tính cứng vĩnh cửu.
3. Tác hại của nước cứng
Nước cứng gây nhiều tác hại trong đời sống và sản xuất:
- Ống dẫn nước cứng, nồi hơi sử dụng nước cứng lâu ngày sẽ bị đóng cặn (thành phần chính là CaCO3 và MgCO3). Lớp cặn này làm giảm lưu lượng nước trong ống dẫn, làm hỏng thiết bị, làm tiêu hao thêm nhiên liệu khi đun nóng nồi hơi, thậm chí có thể gây nồ nồi hơi.
- Nước cứng làm giảm tác dụng của xà phòng; làm hại quần áo.
- Nước cứng làm giảm hương vị của trà khi pha và của thực phẩm khi nấu.
II. LÀM MỀM NƯỚC CỨNG
Để hạn chế tác hại của nước cứng, cần có các biện pháp xử lí nước phù hợp để làm giảm tính cứng của nước, được gọi là làm mềm nước cứng.
Nguyên tắc làm mềm nước cứng là làm giảm nồng độ của các cation Ca2+ và Mg2+ trong nước cứng.
1. Phương pháp kết tủa
Cơ sở của phương pháp này là chuyển cation Ca2+, Mg2+ trong nước về dạng chất không tan, có thể dễ dàng tách ra khỏi nước bằng cách lắng, lọc,...
- Khi đun sôi nước cứng, muối Ca(HCO3)2 và Mg(HCO3)2 bị phân huỷ tạo ra muối không tan, làm mất tính cứng tạm thời của nước.
Ví dụ:
Mg(HCO3)2(aq) MgCO3(s) + CO2(g) + H2O(l)
- Dùng Ca(OH)2 với lượng vừa đủ để phản ứng với muối Ca(HCO3)2 và Mg(HCO3)2 tạo ra hợp chất không tan, làm mất tính cứng tạm thời của nước.
Ví dụ:
Ca(HCO3)2(aq) + Ca(OH)2(aq) 2CaCO3(s) + 2H2O(l)
- Dùng Na2CO3hoặc Na3PO4 để làm mất tính cứng tạm thời và tính cứng vĩnh cửu của nước.
Ví dụ:
MgSO4(aq) + Na2CO3(aq) Na2SO4(aq) + MgCO3(s)
Mg(HCO3)2(aq) + Na2CO3(aq) 2NaHCO3 (aq) + MgCO3(s)
3CaCl2(aq) + 2Na3PO4(aq) 6NaCl(aq) + Ca3(PO4)2(s)
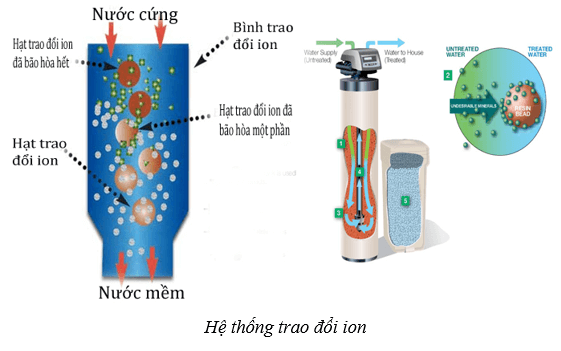
2.Phương pháp trao đổi ion
- Cơ sở của phương pháp này là thay thế cation Ca2+ và Mg2+ trong nước bằng cation khác ít gây tác hại hơn.
- Phương pháp này được thực hiện bằng cách cho nước cứng đi qua lớp vật liệu hay màng vật liệu trao đổi ion. Các vật liệu này có chứa cation kim loại, như Na+. Khi cho nước cứng đi qua vật liệu, các cation Ca2+ và Mg2+ đẩy cation Na+ ra khỏi vật liệu. Các cation Ca2+, Mg2+ bị giữ lại trên vật liệu.
- Phương pháp trao đổi ion làm giảm được cả tính cứng tạm thời và tính cứng vĩnh cửu.
Hạn chế cơ bản của phương pháp này là sau thời gian sử dụng, khả năng giữ các cation Ca2+ và Mg2+ của vật liệu sẽ giảm, khi đó, vật liệu cần được tái chế hoặc thay mới.
Xem thêm tóm tắt lý thuyết Hóa học lớp 12 Cánh diều hay khác:
Xem thêm các tài liệu học tốt lớp 12 hay khác:
- Giải sgk Hóa học 12 Cánh diều
- Giải Chuyên đề học tập Hóa 12 Cánh diều
- Giải SBT Hóa học 12 Cánh diều
- Giải lớp 12 Cánh diều (các môn học)
- Giải lớp 12 Kết nối tri thức (các môn học)
- Giải lớp 12 Chân trời sáng tạo (các môn học)
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều





 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

