Lý thuyết Hợp kim – Sự ăn mòn kim loại (Hóa 12 Cánh diều Bài 16)
Với tóm tắt lý thuyết Hóa 12 Bài 16: Hợp kim – Sự ăn mòn kim loại sách Cánh diều hay nhất, chi tiết sẽ giúp học sinh lớp 12 nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 12.
Lý thuyết Hợp kim – Sự ăn mòn kim loại (Hóa 12 Cánh diều Bài 16)
I. HỢP KIM
1. Khái niệm hợp kim và việc sử dụng phổ biến của hợp kim
- Hợp kim là vật liệu kim loại có chứa một kim loại cơ bản và một số kim loại khác hoặc phi kim. Ví dụ: Thép là hợp kim, trong đó kim loại cơ bản là sắt, phi kim là carbon và một số kim loại như chromium, nickel …
- Hợp kim thường khó bị oxi hóa và có một số tính chất đáp ứng được nhiều mục đích sử dụng khác nhau. Vì vậy trong thực tế, hợp kim được sử dụng phổ biến hơp kim loại. Chúng là vật liệu để chế tạo dụng cụ, thiết bị, máy móc, khung của các công trình xây dựng.
2. Tính chất của hợp kim
- Tính chất hóa học của hợp kim thường tương tự tính chất hóa học của các đơn chất thành phần tham gia tạo hợp kim.
- Tính chất vật lý và tính chất cơ học của hợp kim thường khác nhiều so với tính chất của các đơn chất thành phần tham gia tạo hợp kim. Chẳng hạn, so với đơn chất kim loại, hợp kim có thể cứng hơn, nóng chảy ở nhiệt độ thấp hơn hoặc cao hơn.
3. Một số hợp kim của sắt và nhôm
a) Hợp kim của sắt
- Hầu hết các hợp kim của sắt là thép. Các loại thép có thành phần khác nhau nên có tính chất và ứng dụng khác nhau. Ví dụ:
+ Fe và C tạo thép thường, có độ cứng và độ dẻo phù hợp để làm vật liệu trong ngành xây dựng, giao thông và cơ khí.
+ Fe, C, Cr và Ni tạo thép không gỉ, được dùng làm vật liệu chế tạo dao, kéo, dụng cụ phẫu thuật …
+ Fe, C và Mn tạo thép cứng và khó bị mài mòn, được dùng làm vật liệu sản xuất gàu xúc trong máy đào đất, đường ray …
- Gang là hợp kim của sắt và carbon, trong đó có hàm lượng C lớn hơn so với thép. Gang có độ cứng cao nhưng giòn nên khó gia công hơn thép. Gang là vật liệu được dùng để sản xuất đường ống dẫn nước, nồi, chảo, khuôn đúc …
b) Hợp kim của nhôm
Đặc điểm nổi bật nhất của hợp kim nhôm là nhẹ.
Duralumin (hay dural) là loại hợp kim quan trọng nhất của nhôm, có thành phần gồm nhôm, đồng, magnesium, manganese … Tính chất nổi bật của duralumin là nhẹ, cứng và bền. Duralumin được sử dụng nhiều trong lĩnh vực hàng không vũ trụ để chế tạo cánh máy bay; lĩnh vực quốc phòng để chế tạo áp giáp, khiên bảo vệ; lĩnh vực chế tạo ô tô, chế tạo máy; …
II. ĂN MÒN KIM LOẠI
1. Hiện tượng ăn mòn và khái niệm ăn mòn
Sự ăn mòn kim loại là sự phá hủy kim loại hoặc hợp kim do tác dụng của các chất trong môi trường, trong đó kim loại bị oxi hóa.
M → Mn+ + ne
2. Các dạng ăn mòn kim loại
Có hai dạng ăn mòn kim loại là ăn mòn hóa học và ăn mòn điện hóa.
a) Ăn mòn hóa học
Ăn mòn hóa học là quá trình oxi hóa – khử, trong đó các electron của kim loại chuyển trực tiếp đến các chất trong môi trường.
Ví dụ:
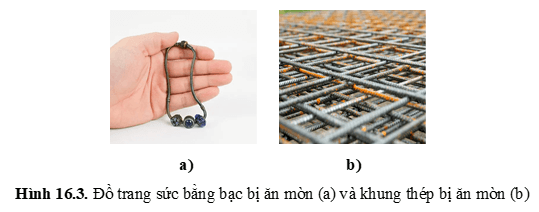
+ Sự xuất hiện lớp silver sulfide (Ag2S) màu đen xám ở bề mặt đồ trang sức bằng bạc là do quá trình oxi hóa Ag bởi O2 trong không khí khi có mặt H2S.
+ Các chi tiết bằng vật liệu kim loại của máy móc dùng trong các nhà máy hóa chất, những thiết bị của lò đốt, nồi hơi, các chi tiết của động cơ đốt trong bị ăn mòn do tác dụng trực tiếp với các hóa chất hoặc oxygen hay với hơi nước ở nhiệt độ cao.
Chú ý: Nhiệt độ càng cao, vật liệu kim loại bị ăn mòn càng nhanh.
b) Ăn mòn điện hóa học
- Ăn mòn điện hóa học (hay ăn mòn điện hóa) là quá trình ăn mòn kim loại do sự tạo thành pin điện hóa.
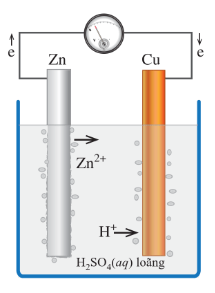
Ví dụ: Xét một thí nghiệm về sự ăn mòn điện hóa
Nhúng thanh kẽm và thanh đồng vào cốc đựng dung dịch sulfuric acid loãng. Nối thanh kẽm với thanh đồng bằng dây dẫn và cho đi qua một vôn kế.
Hiện tượng:
- Khi chưa nối dây dẫn, phần thanh kẽm trong dung dịch bị hòa tan và bọt khí hydrogen thoát ra ở bề mặt thanh kẽm.
- Khi nối dây dẫn, kim vôn kế bị lệch, bọt khí hydrogen thoát ra ở cả thanh đồng, phần thanh kẽm trong dịch bị ăn mòn nhanh.
Giải thích:
- Khi chưa nối dây dẫn, có bọt khí hydrogen thoát ra ở bề mặt thanh kẽm do kim loại này bị ăn mòn hóa học theo phản ứng sau:
Zn(s) + H2SO4(aq) → ZnSO4(aq) + H2(g)
- Khi nối dây dẫn, một pin điện hóa đã được hình thành với kẽm là điện cực âm, đồng là điện cực dương. Trong đó:
+ Ở điện cực âm (anode): Kẽm bị oxi hoá theo quá trình:
Ion Zn2+ đi vào dung dịch, còn electron theo dây dẫn chuyển sang điện cực đồng.
+ Ở điện cực dương (cathode): Ion H+ của dung dịch sulfuric acid bị khử theo quá trình:
Kết quả thanh kẽm bị ăn mòn điện hóa đồng thời với sự tạo thành dòng điện.
- Điều kiện xảy ra sự ăn mòn điện hóa học:
+ Có ít nhất hai kim loại khác nhau hoặc kim loại với phi kim.
+ Tiếp xúc trực tiếp hoặc gián tiếp với nhau qua dây dẫn.
+ Cùng tiếp xúc với một dung dịch chất điện li.
Thiếu một trong ba điều kiện trên sẽ không xảy ra sự ăn mòn điện hóa học.
3. Chống ăn mòn kim loại
Trong tự nhiên, sự ăn mòn kim loại có thể bao gồm cả quá trình ăn mòn điện hóa và ăn mòn hóa học. Sự ăn mòn kim loại gây tổn thất to lớn về tài nguyên và chi phí sửa chữa, thay thế nhiều chi tiết của máy móc, thiết bị dùng trong các nhà máy và công trường, các phương tiện giao thông vận tải, thiết bị và dụng cụ y tế, vật dụng gia đình … Vì vậy, cần sử dụng phương pháp phù hợp để chống ăn mòn kim loại.
a) Phương pháp phủ bề mặt
Phương pháp bảo vệ bề mặt là phủ lên bề mặt của kim loại một lớp sơn, dầu, mỡ, chất dẻo hoặc tráng, mạ bằng một kim loại khác.
b) Phương pháp điện hóa
Trong phương pháp điện hóa, để bảo vệ kim loại, người ta nối kim loại cần bảo vệ với một kim loại hoạt động hóa học mạnh hơn.
Ví dụ: Để bảo vệ vỏ tàu biển làm bằng thép, người ta hàn những khối kẽm lên mặt ngoài của vỏ tàu (phần chìm dưới nước). Kết quả là kim loại kẽm bị nước biển ăn mòn thay cho sắt trong thép.
Xem thêm tóm tắt lý thuyết Hóa học lớp 12 Cánh diều hay khác:
Xem thêm các tài liệu học tốt lớp 12 hay khác:
- Giải sgk Hóa học 12 Cánh diều
- Giải Chuyên đề học tập Hóa 12 Cánh diều
- Giải SBT Hóa học 12 Cánh diều
- Giải lớp 12 Cánh diều (các môn học)
- Giải lớp 12 Kết nối tri thức (các môn học)
- Giải lớp 12 Chân trời sáng tạo (các môn học)
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều





 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

