Lý thuyết Nguyên tố nhóm IIA (Hóa 12 Cánh diều Bài 18)
Với tóm tắt lý thuyết Hóa 12 Bài 18: Nguyên tố nhóm IIA sách Cánh diều hay nhất, chi tiết sẽ giúp học sinh lớp 12 nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 12.
Lý thuyết Nguyên tố nhóm IIA (Hóa 12 Cánh diều Bài 18)
I. TRẠNG THÁI TỰ NHIÊN
- Nhóm IIA gồm các nguyên tố: beryllium (Be), magnesium (Mg), calcium (Ca), strontium (Sr), barium (Ba) và radium (Ra). Trong tự nhiên, magnesium và calcium phổ biến hơn các nguyên tố còn lại.
- Trong vỏ Trái Đất, các nguyên tố nhóm IIA chủ yếu tồn tại ở dạng muối carbonate, sulfate và silicate, tạo nên nhiều loại khoáng vật ít tan.
- Trong nước mặt, nước ngầm,..., các nguyên tố nhóm IIA tồn tại ở dạng cation M2+, phổ biến nhất là Mg2+ và Ca2+.
- Trong cơ thể sinh vật, magnesium và calcium tồn tại ở cả dạng hợp chất ít tan và dạng cation Mg2+, Ca2+.
II. ĐƠN CHẤT
1. Tính chất vật lí
- Giống với kim loại kiềm, kim loại nhóm IIA thuộc nhóm kim loại nhẹ do có khối lượng riêng nhỏ. Chúng có nhiệt độ nóng chảy cao hơn so với kim loại nhóm IA nhưng tương đối thấp so với các kim loại khác.
- Khác với kim loại kiềm, khối lượng riêng và nhiệt độ nóng chảy của kim loại nhóm IIA biến đổi không theo xu hướng rõ rệt.
2. Tính chất hoá học
Trong nhóm IIA, theo chiều tăng điện tích hạt nhân, bán kính của nguyên tử có xu hướng tăng dần từ beryllium đến barium. Điều này làm tăng khả năng nhường electron hoá trị, dẫn đến tính kim loại (hay tính khử) tăng từ beryllium đến barium.
M M2+ + 2e
a) Phản ứng với oxygen
Khi đốt nóng trong oxygen hoặc trong không khí, các kim loại nhóm IIA đều bốc cháy, tạo ra oxide theo phương trình hoá học tổng quát sau:
2M(s) + O2(g) 2MO(s)
Khi cháy, các kim loại nhóm IIA cho ngọn lửa có màu đặc trưng.
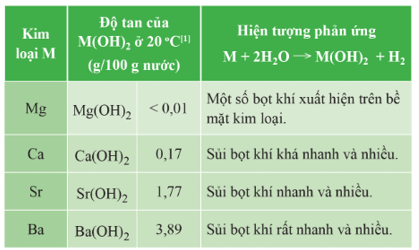
b) Phản ứng với nước
- Beryllium không phản ứng với nước dù đun nóng. Magnesium phản ứng với nước rất chậm ở nhiệt độ thường, phản ứng mạnh hơn khi đun nóng. Calcium, strontium và barium phản ứng mạnh với nước ở nhiệt độ thường và mức độ phản ứng tăng dần.
- Các kim loại nhóm IIA (trừ beryllium) phản ứng với nước tạo ra khí hydrogen và hydroxide kim loại. Mức độ của phản ứng này thường liên quan đến độ tan của hydroxide tạo thành: hydroxide có độ tan lớn hơn thì phản ứng cùa kim loại đó với nước thuận lợi hơn.
3. Ứng dụng
Ứng dụng cơ bản của một số kim loại nhóm IIA là tham gia tạo hợp kim.
Ví dụ: Mg là kim loại cơ bản của nhiều hợp kim, như hợp kim Mg-Al. Các hợp kim này thường có đặc điểm là cứng, bền và nhẹ. Chúng thường được sử dụng để chế tạo các bộ phận của máy bay, ô tô,...
III. HỢP CHẤT CỦA CÁC NGUYÊN TỐ NHÓM IIA
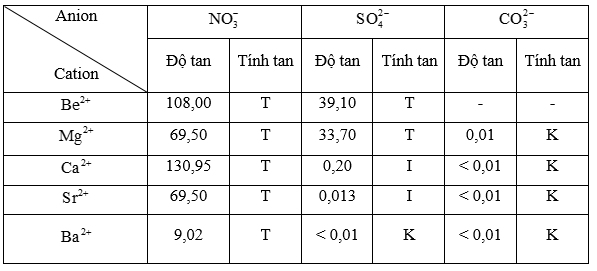
1. Độ tan của một số loại hợp chất
- Tuỳ theo mục đích sử dụng, có nhiều quy ước phân loại chất tan, chất ít tan và chất không tan. Dưới đây là quy ước phổ biến:
|
Loại chất |
Độ tan S (gam/100 gam nước) |
|
Chất tan |
S > 1,00 |
|
Chất ít tan |
0,01 < S ≤ 1,00 |
|
Chất không tan |
S ≤ 0,01 |
- Độ tan và tính tan của một số muối của nguyên tố nhóm IIA được thể hiện trong bảng sau:
2. Một số loại muối phổ biến
|
Muối carbonate |
Muối nitrate |
|
- Muối carbonate của các nguyên tố Mg, Ca, Sr, Ba phản ứng với dung dịch acid và với nước có carbon dioxide hoà tan. - Muối carbonate của các nguyên tố Mg, Ca, Sr, Ba bị nhiệt phân tạo thành oxide kim loại và khí carbon dioxide: - Độ bền nhiệt của các muối tăng từ đến |
- Muối nitrate của các kim loại nhóm IIA bị nhiệt phân tạo thành oxide kim loại, khí nitrogen dioxide và oxygen. Tổng quát: - Độ bền nhiệt của các muối nitrate có xu hướng tăng từ đến |
3. Kiểm tra sự có mặt của ion trong dung dịch
Để nhận biết sự có mặt của mỗi ion Ca2+, Mg2+, trong dung dịch, người ta quan sát các hiện tượng xảy ra (như sự xuất hiện kết tủa, sủi bọt khí …) khi cho các chất phù hợp vào dung dịch.
4. Ứng dụng và vai trò của một số hợp chất của calcium
a) Ứng dụng của một số hợp trong tự nhiên
Thạch cao, apatite, đá vôi, vôi sống, vôi tôi có thành phần chính là các hợp chất của calcium. Chúng là các chất rắn tương đối bền đối với nhiệt, không tan hoặc ít tan trong nước; chúng là các nguyên liệu, vật liệu phổ biến và có nhiều ứng dụng trong đời sống, sản xuất.
b) Vai trò của hợp chất calcium trong cơ thể người
Trong cơ thể người:
- Một số hợp chất không tan của calcium cấu tạo nên xương và răng, giúp phát triển, ổn định xương và răng.
- Một số hợp chất tan cùa calcium giúp ổn định chức năng truyền dẫn tín hiệu thần kinh đến tế bào, chức năng co giãn của cơ bắp (bao gồm cả cơ tim).
IV. NHẬN BIẾT KIM LOẠI VÀ ION KIM LOẠI NHÓM IIA
Có thể nhận biết Ca, Cs, Ba và hợp chất của chúng dựa vào màu ngọn lửa khi đốt chúng:
+ Ca và hợp chất của Ca: ngọn lửa có màu đỏ cam.
+ Sr và hợp chất của Sr: ngọn lửa có màu đỏ son.
+ Ba và hợp chất của Ba: ngọn lửa có màu lục.
Xem thêm tóm tắt lý thuyết Hóa học lớp 12 Cánh diều hay khác:
Xem thêm các tài liệu học tốt lớp 12 hay khác:
- Giải sgk Hóa học 12 Cánh diều
- Giải Chuyên đề học tập Hóa 12 Cánh diều
- Giải SBT Hóa học 12 Cánh diều
- Giải lớp 12 Cánh diều (các môn học)
- Giải lớp 12 Kết nối tri thức (các môn học)
- Giải lớp 12 Chân trời sáng tạo (các môn học)
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều

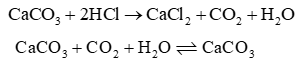
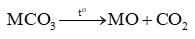
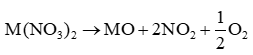



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

