Lý thuyết Tính chất hoá học của carbohydrate (Hóa 12 Cánh diều Bài 4)
Với tóm tắt lý thuyết Hóa 12 Bài 4: Tính chất hoá học của carbohydrate sách Cánh diều hay nhất, chi tiết sẽ giúp học sinh lớp 12 nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 12.
Lý thuyết Tính chất hoá học của carbohydrate (Hóa 12 Cánh diều Bài 4)
I. TÍNH CHẤT HÓA HỌC CỦA GLUCOSE VÀ FRUCTOSE
Glucose và fructose đều thể hiện tính chất của alcohol đa chức và cùa hợp chất carbonyl.
1. Phản ứng với copper(II) hydroxide
- Glucose và fructose tác dụng với copper(II) hydroxide trong môi trường kiềm ở điều kiện thường tạo thành phức chất màu xanh lam, tan trong nước.
2C6H12O6 + Cu(OH)2 → Cu(C6H11O6)2 + 2H2O
- Đun nóng dung dịch chứa glucose và Cu(OH)2 trong môi trường kiềm sẽ xuất hiện kết tủa màu đỏ gạch do Cu(OH)2 bị khử thành Cu2O. Đây là tính chất của nhóm chức aldehyde trong phân tử glucose.
- Fructose cũng tham gia phản ứng như trên và tạo thành kết tủa đỏ gạch Cu2O tương tự như glucose do trong môi trường kiềm, fructose có thể chuyển hoá thành hợp chất có nhóm chức -CHO.
2. Phản ứng với thuốc thử Tollens
- Khi trộn dung dịch silver nitrate với dung dịch ammonia thu được thuốc thử Tollens.
Thuốc thử Tollens dùng để nhận biết các hợp chất có nhóm chức aldehyde do tạo thành kết tủa bạc (phản ứng tráng bạc).
- Glucose và fructose đều tham gia phản ứng với thuốc thử Tollens để tạo thành kết tủa bạc kim loại (phản ứng tráng bạc).
Ví dụ:
CH2OH[CHOH]4CHO + 2[Ag(NH3)2]OH → CH2OH[CHOH]4COONH4 + 2Ag + 3NH3 + H2O
3. Phản ứng với nước bromine
- Phản ứng của glucose với nước bromine làm nước bromine bị mất màu và tạo thành gluconic acid theo phương trình hoá học sau:
CH2OH[CHOH]4CHO + Br2 + H2O → CH2OH[CHOH]4COOH + 2HBr
- Fructose không làm mất màu nước bromine.
4. Phản ứng với alcohol
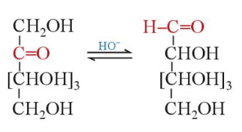
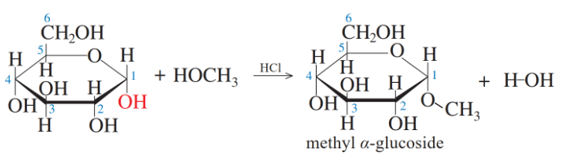
Khi dẫn khí hydrogen chloride vào dung dịch của glucose trong alcohol, nhóm -OH hemiacetal dược thay thế bằng nhóm -OR của alcohol.
Ví dụ:
Lưu ý: Trong phản ứng trên, sản phẩm sinh ra ở dạng hỗn hợp các đồng phân α và đồng phân β.
5. Phản ứng lên men
Glucose và fructose bị lên men tạo thành các sản phẩm khác nhau, tuỳ thuộc vào loại enzyme có trong men được sử dụng.
Ví dụ:
Lên men rượu: C6H12O6 2C2H5OH + 2CO2
Lên men lactic: C6H12O6 2CH3CH(OH)COOH
II. TÍNH CHẤT HOÁ HỌC CỦA SACCHAROSE
Saccharose có những tính chất của một alcohol đa chức. Ngoài ra, saccharose thuộc loại disaccharide nên có thể tham gia phản ứng thuỷ phân để tạo thành các monosaccharide.
1. Phản ứng với copper(II) hydroxide
Dung dịch màu xanh lam được được tạo thành khi cho dung dịch saccharose tác dụng với copper(II) hydroxide trong môi trường kiềm.
2C12H22O11 + Cu(OH)2 → Cu(C12H21O11)2 + 2H2O
2. Phản ứng thuỷ phân
Saccharose bị thuỷ phân tạo thành glucose và fructose. Phản ứng xảy ra khi có xúc tác acid hoặc có mặt của enzyme.
III. TÍNH CHẤT HOÁ HỌC CỦA TINH BỘT
1. Phản ứng của iodine
- Tinh bột có khoảng 20-30% amylose. Phân tử amylose ở dạng vòng xoắn nên khi tương tác với iodine, vòng này đã bọc (hay hấp phụ) các phân tử iodine tạo hợp chất bọc có màu xanh tím.
- Phân tử tinh bột hấp phụ iodine tạo thành hợp chất có màu xanh tím. Quá trình này được dùng để nhận ra tinh bột bằng iodine và ngược lại.
2. Phản ứng thủy phân
Phản ứng thuỷ phân tinh bột xảy ra khi có xúc tác acid (hoặc enzyme) và diễn ra qua nhiều giai đoạn. Các giai đoạn trung gian tạo thành dextrin (C6H10O5)x (với x < n) và maltose. Sản phẩm cuối cùng của quá trình thuỷ phân là glucose.
IV. TÍNH CHẤT HOÁ HỌC CỦA CELLULOSE
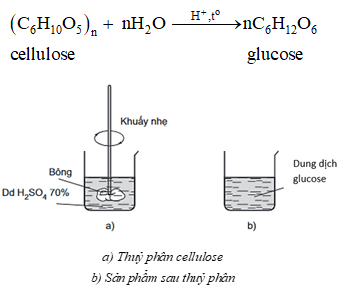
1. Phản ứng thủy phân
Cellulose bị thuỷ phân khi đun nóng với dung dịch acid vô cơ hoặc khi có mặt enzyme cellulase (thường có trong dạ dày động vật ăn cỏ). Sản phẩm cuối cùng nhận được khi thuỷ phân cellulose là glucose.
2. Phản ứng với nitric acid
Các nhóm hydroxy trong các đơn vị glucose của phân tử cellulose phản ứng với dung dịch nitric acid đặc khi có mặt dung dịch sulfuric acid đặc, tạo ra các sản phẩm như cellulose trinitrate, cellulose dinitrate tuỳ thuộc vào điều kiện phản ứng.
3. Tác dụng với nước Schweizer
Cellulose không tan trong nước nhưng tan trong nước Schweizer (dung dịch chứa phức chất của ion Cu2+ với ammonia).
Xem thêm tóm tắt lý thuyết Hóa học lớp 12 Cánh diều hay khác:
Xem thêm các tài liệu học tốt lớp 12 hay khác:
- Giải sgk Hóa học 12 Cánh diều
- Giải Chuyên đề học tập Hóa 12 Cánh diều
- Giải SBT Hóa học 12 Cánh diều
- Giải lớp 12 Cánh diều (các môn học)
- Giải lớp 12 Kết nối tri thức (các môn học)
- Giải lớp 12 Chân trời sáng tạo (các môn học)
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều




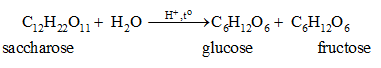

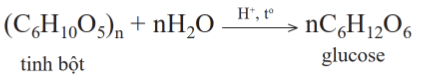
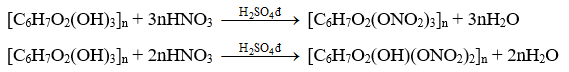



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

