125 câu trắc nghiệm Nhóm Oxi, Lưu huỳnh có lời giải (nâng cao - phần 3)
Với 125 câu trắc nghiệm Nhóm Oxi, Lưu huỳnh (nâng cao - phần 3) có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm câu trắc nghiệm Nhóm Oxi, Lưu huỳnh (nâng cao - phần 3).
125 câu trắc nghiệm Nhóm Oxi, Lưu huỳnh có lời giải (nâng cao - phần 3)
Thi online Hóa 10 KNTTThi online Hóa 10 CDThi online Hóa 10 CTST
Bài 1:Cho các phản ứng sau:
(1) Na2SO3+ HCl → khí X
(2) KMnO4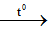
(3) Ca(HCO3)2 + HCl → khí Z
(4) FeS + HCl → khí T
Cho hỗn hợp chứa các khí trên đi qua bình đựng dung dịch NaOH dư. Số khí thoát ra khỏi bình là
A. 2.
B. 4.
C. 3.
D. 1.
Lời giải:
Hướng dẫn giải:
Đáp án D.
(1) Na2SO3+ HCl → 2NaCl + H2O + SO2
(2) 2KMnO4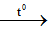
(3) Ca(HCO3)2 + 2HCl → CaCl2 + H2O + CO2
(4) FeS + 2HCl → FeCl2 + H2S
Khí thoát ra khỏi bình là khí không phản ứng với NaOH. O2 không phản ứng với NaOH.
Bài 2:Hòa tan hỗn hợp gồm Fe và FeS vào dung dịch HCl dư, thu được 8,96 lít hỗn hợp khí (đktc). Cho hỗn hợp khí này đi qua dung dịch Pb(NO3)2 dư thì thu được 23,9 gam kết tủa đen. Khối lượng Fe trong hỗn hợp đầu là
A. 11,2
B. 16,8
C. 5,6
D. 8,4
Lời giải:
Hướng dẫn giải:
Đáp án B
FeS + 2HCl → FeCl2 + H2S
Fe + 2HCl → FeCl2 + H2
Pb(NO3)2 + H2S → PbS + 2HNO3
nkhí = 8,96/22,4 = 0,4 (mol) ;nH2S = nPbS = 0,1 (mol)
⇒ nFe =nH2 = 0,4 – 0,1 = 0,3 (mol) ⇒ mFe = 0,3.56 = 16,8 (gam)
Bài 3:Điều chế khí Y trong phòng thí nghiệm
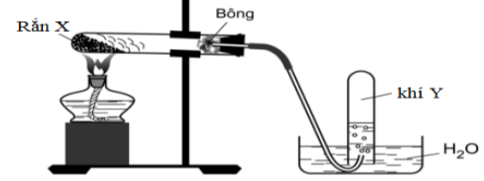
Cho các nhận định sau:
(a) Chất rắn X là KMnO4 thì khí Y là O2.
(b) Chất rắn X là NaNO3 thì khí Y là N2.
(c) Chất rắn X là KClO3 thì khí Y là Cl2.
(d) Chất rắn X là CaCO3 thì khí Y là O2.
Số nhận định đúng là
A. 2.
B. 3.
C. 1.
D. 4.
Lời giải:
Hướng dẫn giải: Đáp án A.
Bài 4:Điều chế oxi trong phòng thí nghiệm theo mô hình sau:

Nhận định nào sau đây là sai?
A. X là KMnO4.
B. X là NaHCO3.
C. X là (KClO3 + MnO2).
D. X là NaNO3.
Lời giải:
Hướng dẫn giải: Đáp án B.
Bài 5:Đun nóng 20 gam một hỗn hợp X gồm Fe và S trong điều kiện không có không khí thu được hỗn hợp rắn A. Hòa tan hỗn hợp rắn A vào dung dịch HCl thu được 6,72 lít (đktc) hỗn hợp khí Y. Thành phần phần trăm khối lượng Fe trong X là
A. 28%
B. 56%
C. 42%
D. 84%
Lời giải:
Hướng dẫn giải:
Đáp án D.
Fe + S → FeS
FeS + 2HCl → FeCl2 + H2S;
Fe + 2HCl → FeCl2 + H2
nFe(bđ) = nFeS + nFe(dư) = nH2S + nH2 = 6,72/22,4 = 0,3 (mol)
%mFe = (0,3.56)/20= 84%
Bài 6:Nung nóng m gam PbS ngoài không khí sau một thời gian, thu được hỗn hợp rắn (có chứa một oxit) nặng 0,95 m gam. Phần trăm khối lượng PbS đã bị đốt cháy là
A. 74,69%
B. 95,00%
C. 25,31%
D. 64,68%
Lời giải:
Hướng dẫn giải:
Đáp án A.
0,95m (g) → hh (PbO và PbS dư) + SO2
Áp dụng ĐLBTKH ta có:
mO = m – 0,95m = 0,05m (g) → nO = 3,125.10-3 m (mol)
Ta có: nPbS phản ứng = nPbO = nO = 3,125.10-3 m (mol)
→ %PbS (đã bị đốt cháy) = (3,125. 10-3 m.239.100% )/m = 74,69%
Bài 7:Cho các phản ứng sau:
(1) SO2 + H2S → S + H2O
(2) SO2 + KMnO4 + H2O → MnSO4 + K2SO4 + H2SO4
(3) SO2 + Br2 + H2O → H2SO4 + HBr
(4) SO2 + Ca(OH)2 → Ca(HSO3)2
Số phản ứng mà SO2 đóng vai trò là chất khử là
A. 2.
B. 1.
C. 3.
D. 4.
Lời giải:
Hướng dẫn giải:
Đáp án A.
Phản ứng 2, 3
(2) 5S+4O2 + 2KMnO4 + 2H2O → 2MnSO4 + K2SO4 + 2H2S+6O4
(3)S+4O2 + Br2 + 2H2O → H2S+6O4 + 2HBr
Bài 8:Từ 1,6 tấn quặng có chứa 60% FeS2, người ta có thể sán xuất được khối lượng axit sunfuric là bao nhiêu?
A. 1558kg
B. 1578kg
C. 1548kg
D. 1568kg
Lời giải:
Hướng dẫn giải:
Đáp án D
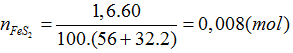
FeS2 → 2SO2 → 2SO3 → 2H2SO4
0,008 0,016 (tấn mol)
mH2SO4=0,16.98.1000=1568(kg)
Bài 9:Hòa tan hoàn toàn 2,81 gam hỗn hợp gồm Fe2O3, MgO, ZnO trong 500 ml axit H2SO4 0,1M (vừa đủ). Sau phản ứng cô cạn dung dịch hỗn hợp muối sunfat khan thu được có khối lượng là
A. 6,81 gam
B. 4,81 gam
C. 3,81 gam
D. 5,81 gam
Lời giải:
Hướng dẫn giải:
Đáp án A.
mH2SO4 =mH20 = 0,1.0,5 = 0,05 (mol)
Bảo toàn khối lượng: 2,81 + 0,05.98 = m + 0,05.18
m = 6,81 gam
Bài 10:Trong phòng thí nghiệm khí oxi có thể được điều chế bằng cách nhiệt phân muối KClO3 có MnO2 làm xúc tác và có thể được thu bằng cách đẩy nước hay đẩy không khí:
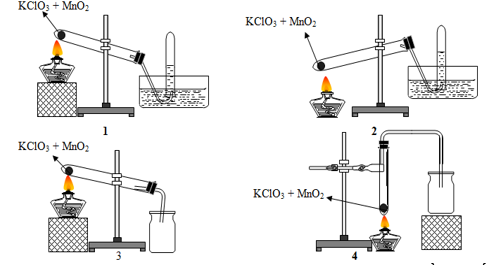
Trong các hình vẽ cho ở trên, hình vẽ mô tả điều chế và thu khí oxi đúng cách là
A. 1 và 2.
B. 2 và 3.
C. 1 và 3.
D. 3 và 4.
Lời giải:
Hướng dẫn giải: Đáp án C.
Bài 11:Hình vẽ mô tả điều chế khí SO2 trong phòng thí nghiệm:
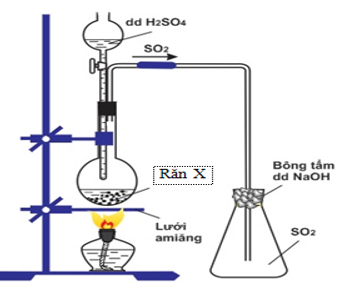
Điều nào sau đây là sai?
A. X là Na2SO3.
B. X là NaHSO3.
C. X là FeS.
D. X là Ba(HSO3)2.
Lời giải:
Hướng dẫn giải: Đáp án C.
Bài 12:Hoà tan hoàn toàn 6,05 g hỗn hợp X gồm Fe, Mg Zn bằng một lượng vừa đủ H2SO4 loãng thấy thoát 2,688 H2 ở đktc và dung dịch chứa m gam muối. Giá trị của m là:
A. 17,57g
B.18,98
C.17,25g
D. 9,52g
Lời giải:
Hướng dẫn giải:
Đáp án A.
nH2 = 0,12 (mol)=nH2SO4
Bảo toàn khối lượng: 6,05 + 0,12.98 = m + 0,12.2
m = 17,57 gam
Bài 13:Hòa tan hoàn toàn 5,5 gam hỗn hợp gồm Al và Fe vào lượng dư dung dịch H2SO4 loãng, thu được 4,48 lít H2 (đktc). Thành phần phần trăm khối lượng của Fe trong hỗn hợp đầu là
A. 50,91%
B. 76,36%
C. 25,45%
D. 12,73%
Lời giải:
Hướng dẫn giải:
Đáp án A
nH2 = 0,2 (mol)
⇒ mhh= mFe + mAl
Bảo toàn electron: 2nFe + 3nAl =2
⇒ 56nFe + 27nAl = 5,5 ; 2nFe + 3nAl = 2.0,2
⇒ nFe = 0,05 ; nAl = 0,1 ⇒ %mFe = 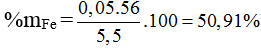
Bài 14:Cho m gam hỗn hợp X gồm Al, Cu vào dung dịch H2SO4 loãng (dư), thu được 6,72 lít khí (đktc). Nếu cho m gam hỗn hợp X trên vào một lượng dư dung dịch H2SO4 (đặc, nguội), thu được 6,72 lít khí SO2 (sản phẩm khử duy nhất, ở đktc). Giá trị của m là
A. 23,0
B. 21,0
C. 24,6
D. 30,2
Lời giải:
Hướng dẫn giải:
Đáp án C
nH2 = 0,3 (mol);nSO2 = 0,3 (mol)
Bảo toàn electron:
3nAl = 2nH2 ; 2nCu = 2nSO2
⇒ nAl = 0,2; nCu = 0,3 ⇒ m = 0,2.27 + 0,3.64 = 24,6 (gam)
Lưu ý: khi cho X vào H2SO4 loãng chỉ có Al phản ứng.
Khi cho X vào H2SO4 đặc nguội chỉ có Cu phản ứng
Bài 15:Dẫn mẫu khí thải của một nhà máy qua dung dịch Pb(NO3)2 dư thì thấy xuất hiện kết tủa màu đen. Hiện tượng đó chứng tỏ trong khí thải nhà máy có khí nào sau đây?
A. SO2.
B. H2S.
C. NH3.
D. CO2.
Lời giải:
Hướng dẫn giải:
Đáp án B
H2S + Pb(NO3)2 → PbS + 2HNO3
Bài 16:Mưa axit ảnh hưởng tới hệ thực vật, phá hủy các vật liệu bằng kim loại, các bức tượng bằng đá, gây bệnh cho con người và động vật. Hiện tượng trên gây ra chủ yếu do khí thải của nhà máy nhiệt điện, phương tiện giao thông và sản xuất công nghiệp. Tác nhân chủ yếu trong khí thải gây ra mưa axit là
A. SO2 và NO2.
B. CH4 và NH3.
C. CO và CH4.
D. CO và CO2.
Lời giải:
Hướng dẫn giải: Đáp án A
Bài 17:Hòa tan hoàn toàn 3,22 gam hỗn hợp X gồm Fe, Mg và Zn bằng 1 lượng vừa đủ dung dịch H2SO4 loãng, thu được 1,344 lít khí hidro (đktc) và dung dịch chứa m gam muối. Giá trị của m là
A. 9,52
B. 10,27
C. 8,98
D. 7,25
Lời giải:
Hướng dẫn giải:
Đáp án C
nH2 = 0,06 (mol) ⇒ nH2SO4 =nH2 = 0,06 mol
Bảo toàn khối lượng: 3,22 + 0,06.98 = m + 0,06.2
m = 8,98 gam
Bài 18:Cho các phản ứng sau:
a. FeS2 + O2 → X + Y
b. X + H2S → Z + H2O
c. Z + T → FeS
d. FeS + HCl → M + H2S
e. M + NaOH → Fe(OH)2 + N.
Các chất được ký hiệu bằng chữ cái X, Y, Z, T, M, N có thể là:
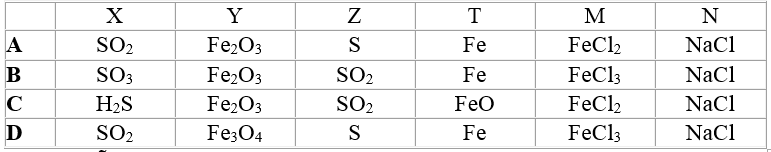
Lời giải:
Hướng dẫn giải:
Đáp án A.
a. 4FeS2 + 11O2 → 8SO2 + 2Fe2O3
b. SO2 + 2H2S → 3S + 2H2O
c. S + Fe → FeS
d. FeS + 2HCl → FeCl2 + H2S
e. FeCl2 + 2NaOH → Fe(OH)2 + 2NaCl.
Bài 19:Cho các phát biểu sau:
(1) Để xử lý thủy ngân rơi vãi, người ta có thể dùng bột lưu huỳnh.
(2) Khi thoát vào khí quyển, freon phá hủy tần ozon.
(3) sulfur dioxide là chất khí không màu, mùi hắc, nặng hơn không khí.
(4) sulfur trioxide là chất khí không màu, tan vô hạn trong nước và tạo thành axit sunfuric.
Trong các phát biểu trên, số phát biểu đúng là
A. 3.
B. 4.
C. 2.
D. 1.
Lời giải:
Hướng dẫn giải:
Đáp án A.
Các phát biểu đúng: 1,2,3.
Bài 20:Cho các phát biểu sau:
(a) Sục khí SO2 vào dung dịch NaOH dư tạo ra muối trung hòa Na2SO3.
(b) SO2 vừa có tính khử, vừa có tính oxi hóa.
(c) Khí SO2 là một trong những nguyên nhân chính gây ra mưa axit.
(d) Khí SO2 có màu vàng lục và rất độc.
Số phát biểu đúng là
A. 3.
B. 1.
C. 4.
D. 2.
Lời giải:
Hướng dẫn giải:
Đáp án A.
Các phát biểu đúng a,b,c
Bài 21:Nung hỗn hợp bột kim loại gồm 11,2 gam Fe và 6,5 gam Zn với một lượng S dư (trong điều kiện không có không khí), thu được hỗn hợp rắn X. Hòa tan hoàn toàn X trong dung dịch HCl dư thu được khí Y. Hấp thụ toàn bộ Y vào dung dịch NaOH 1M. Thể tích dung dịch NaOH 1M tối thiểu để hấp thụ hết khí Y là
A. 200 ml
B. 300 ml
C. 400 ml
D. 100 ml
Lời giải:
Hướng dẫn giải:
Đáp án B.
nFe = 0,2 mol; nZn = 0,1 mol
NaOH + H2S → NaHS + H2O
nNaOH =nH2S = nFeS + nZnS = 0,3 mol ⇒ V = 0,3 lít
Bài 22:Dẫn từ từ V lít khí SO2 (đktc) vào lượng dư dung dịch Br2, không thấy khí thoát ra. Thêm tiếp dung dịch BaCl2 dư vào dung dịch sau phản ứng, thu được 23,3 gam kết tủa. Giá trị của V là
A. 4,48
B. 1,12
C. 3,36
D. 2,24
Lời giải:
Hướng dẫn giải:
Đáp án D.
SO2 + Br2 + 2H2O → H2SO4 + 2HBr
BaCl2 +H2SO4 → BaSO4 + 2HCl
nSO2 =nH2SO4 =nBaSO4= 0,1 mol ⇒ V = 0,1.22,4 = 2,24 lít
Bài 23:Có các thí nghiệm sau:
(I) Nhúng thanh sắt vào dung dịch H2SO4 loãng, nguội.
(II) Sục khí SO2 vào nước brom.
(III) Sục khí CO2 vào nước Gia-ven.
(IV) Nhúng lá nhôm vào dung dịch H2SO4 đặc, nguội.
Số thí nghiệm xảy ra phản ứng hóa học là
A. 4.
B. 3.
C. 1.
D. 2.
Lời giải:
Hướng dẫn giải:
Đáp án B.
Các phản ứng 1,2,3.
Fe + H2SO4 → FeSO4 + H2
SO2 + H2O + Br2 → 2HBr + H2SO4
CO2 + NaClO + H2O → NaHCO3 + HClO
Bài 24:Cho 25,5 gam hỗn hợp X gồm CuO và Al2O3 tan hoàn toàn trong dung dịch H2SO4 loãng, thu được dung dịch chứa 57,9 gam muối. Phần tẳm khối lượng của Al2O3 trong X là
A. 60%
B. 40%
C. 80%
D. 20%
Lời giải:
Hướng dẫn giải:
Đáp án D.
CuO → CuSO4
a a (mol)
Al2O3 → Al2(SO4)3
b b (mol)
80a + 102b = 25,5
160a + 342b = 57,9
⇒ a =0,255 , b =0,05 (mol)
⇒ 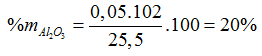
Sử dụng thông tin trả lời câu hỏi 90, 91.
Hòa tan hoàn toàn 24 gam hỗn hợp X gồm MO, M(OH)2 và MCO3 (M là kim loại có hóa trị không đổi) trong 100 gam dung dịch H2SO4 39,2%, thu được 1,12 lít khí(đktc) và dung dịch Y chỉ chứa một chất tan duy nhất có nồng độ 39,41%.
Bài 25:Khối lượng dung dịch sau phản ứng là:
A. 100 g
B. 121,8
C. 124
D. 125,3
Lời giải:
Đáp án B
Bài 26:Kim loại M là
A. Zn
B. Ca
C. Mg
D. Cu
Lời giải:
Đáp án C
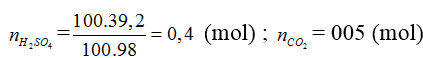
(MO, M(OH)2, MCO3) + H2SO4 → MSO4 + CO2 + H2O
mdd Y = 24 + 100 – 0,05.44 = 121,8 (gam)
Bài 27:Có thể điều chế O2 bằng cách phân huỷ KMnO4, KClO3, H2O2. Nếu lấy cùng một lượng các chất trên đem phân huỷ hoàn toàn thì thể tích oxi trong cùng điều kiện thu được
A. Từ KMnO4 là lớn nhất
B. Từ KClO3 là lớn nhất
C. Từ H2O2 là lớn nhất
D. bằng nhau
Lời giải:
Hướng dẫn giải:
Đáp án B.
PTHH: 2KMnO4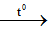
K2MnO4 + MnO2 + O2
m/158 m/79
2H2O2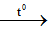
2H2O + O2
m/34 m/17
2KClO3 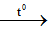
2KCl + 3O2
m/122,5 3m/245
Bài 28:Trong công nghiệp, axit sunfuric được điều chế từ quang pirit sắt. Khối lượng H2SO4 điều chế được từ 1,5 tấn quặng pirit sắt có chứa 80% FeS2 ( hiệu suất toàn quá trình là 80%) là
A. 1,568 tấn
B. 1,96 tấn
C. 1,25 tấn
D. 2,00 tấn
Lời giải:
Hướng dẫn giải:
Đáp án A.
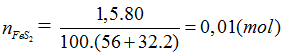
FeS2 → 2H2SO4 (Bảo toàn S)
0,01 → 0,02 (mol)
Do hiệu suất là 80% ⇒ nH2SO4 = 0,02.0,8 = 0,016 (mol)
mH2SO4 =0,016.98 =1,568 tấn
Bài 29:Khi hòa tan hidroxit kim loại M(OH)2 bằng một lượng vừa đủ dung dịch H2SO4 20%, thu được dung dịch muối trung hòa có nồng độ 27,21%. Kim loại M là
A. Cu
B. Zn
C. Fe
D. Mg
Lời giải:
Hướng dẫn giải:
Đáp án A.
Coi = 1 mol
M(OH)2 + H2SO4 → MSO4 + 2H2O
mddH2SO4 = 1.98.100/20 = 490 (gam)
⇒ mdd sau = (M + 34) + 490 = M + 524
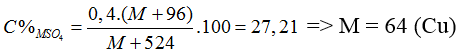
Bài 30:H2S bị oxi hóa thành lưu huỳnh màu vàng khi:
1) Dẫn khí H2S qua dung dịch FeCl3
2) Để dung dịch H2S ngoài trời
3) Đốt khí H2S ở điều kiện thiếu oxi
A. 1 và 2
B. 1 và 3
C. 2 và 3
D. 1, 2 và 3
Lời giải:
Hướng dẫn giải:
Đáp án B.
Các phương trình phản ứng xảy ra:
H2S + 2FeCl3 → 2FeCl2 + S↓ + 2HCl
2H2S + O2 → 2S↓ + 2H2O
Thi online Hóa 10 KNTTThi online Hóa 10 CDThi online Hóa 10 CTST
Xem thêm các dạng bài tập Hóa học lớp 10 có trong đề thi Tốt nghiệp THPT khác:
- 125 câu trắc nghiệm Nhóm Oxi, Lưu huỳnh có lời giải (cơ bản - phần 1)
- 125 câu trắc nghiệm Nhóm Oxi, Lưu huỳnh có lời giải (cơ bản - phần 2)
- 125 câu trắc nghiệm Nhóm Oxi, Lưu huỳnh có lời giải (cơ bản - phần 3)
- 125 câu trắc nghiệm Nhóm Oxi, Lưu huỳnh có lời giải (cơ bản - phần 4)
- 125 câu trắc nghiệm Nhóm Oxi, Lưu huỳnh có lời giải (nâng cao - phần 1)
- 125 câu trắc nghiệm Nhóm Oxi, Lưu huỳnh có lời giải (nâng cao - phần 2)
- 125 câu trắc nghiệm Nhóm Oxi, Lưu huỳnh có lời giải (nâng cao - phần 4)
Để học tốt lớp 10 các môn học sách mới:
- Giải bài tập Lớp 10 Kết nối tri thức
- Giải bài tập Lớp 10 Chân trời sáng tạo
- Giải bài tập Lớp 10 Cánh diều
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Lớp 10 - Kết nối tri thức
- Soạn văn 10 (hay nhất) - KNTT
- Soạn văn 10 (ngắn nhất) - KNTT
- Soạn văn 10 (siêu ngắn) - KNTT
- Giải sgk Toán 10 - KNTT
- Giải sgk Vật lí 10 - KNTT
- Giải sgk Hóa học 10 - KNTT
- Giải sgk Sinh học 10 - KNTT
- Giải sgk Địa lí 10 - KNTT
- Giải sgk Lịch sử 10 - KNTT
- Giải sgk Kinh tế và Pháp luật 10 - KNTT
- Giải sgk Tin học 10 - KNTT
- Giải sgk Công nghệ 10 - KNTT
- Giải sgk Hoạt động trải nghiệm 10 - KNTT
- Giải sgk Giáo dục quốc phòng 10 - KNTT
- Lớp 10 - Chân trời sáng tạo
- Soạn văn 10 (hay nhất) - CTST
- Soạn văn 10 (ngắn nhất) - CTST
- Soạn văn 10 (siêu ngắn) - CTST
- Giải Toán 10 - CTST
- Giải sgk Vật lí 10 - CTST
- Giải sgk Hóa học 10 - CTST
- Giải sgk Sinh học 10 - CTST
- Giải sgk Địa lí 10 - CTST
- Giải sgk Lịch sử 10 - CTST
- Giải sgk Kinh tế và Pháp luật 10 - CTST
- Giải sgk Hoạt động trải nghiệm 10 - CTST
- Lớp 10 - Cánh diều
- Soạn văn 10 (hay nhất) - Cánh diều
- Soạn văn 10 (ngắn nhất) - Cánh diều
- Soạn văn 10 (siêu ngắn) - Cánh diều
- Giải sgk Toán 10 - Cánh diều
- Giải sgk Vật lí 10 - Cánh diều
- Giải sgk Hóa học 10 - Cánh diều
- Giải sgk Sinh học 10 - Cánh diều
- Giải sgk Địa lí 10 - Cánh diều
- Giải sgk Lịch sử 10 - Cánh diều
- Giải sgk Kinh tế và Pháp luật 10 - Cánh diều
- Giải sgk Tin học 10 - Cánh diều
- Giải sgk Công nghệ 10 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 10 - Cánh diều
- Giải sgk Giáo dục quốc phòng 10 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

