Bài tập về nhóm Halogen chọn lọc, có đáp án
Bài viết nhóm Halogen với phương pháp giải chi tiết giúp học sinh ôn tập, biết cách làm bài tập nhóm Halogen.
Bài tập về nhóm Halogen chọn lọc, có đáp án
Thi online Hóa 10 KNTTThi online Hóa 10 CDThi online Hóa 10 CTST
A. Bài tập tự luận
Bài 1: Điện phân nóng chảy một muối 11,7g halogenua NaX người ta thu được 2,24 lít khí (đktc).
a) Xác định nguyên tố X ?
b) Tính thế tích khí HX thu được khi cho X tác dụng với 4,48 lít H2 ở đktc ?
c) Tính tỷ lệ % các khí sau phản ứng ?
Lời giải:
PTHH: 2NaX → 2Na + X2
a, nX2 = 0,1 mol ⇒ nNaX = 2. 0,1 = 0,2 mol.
MNaX = 11,7/0,2 = 58,5 ⇒ X = 35,5 (Cl)
b, X2 + H2 → 2HX
nH2 = 0,2 mol ⇒ nHX = 2. nX2= 0,2 mol (H2 dư)
⇒ VHX = 0,2.22,4 = 4,48 l
c, Sau phản ứng có 0,2 mol khí HCl và 0,1 mol H2 dư
%HCl= 0,2/(0,2 + 0,1)= 66,67%
⇒ %H2 = 33,33%
Bài 2. Nung 12,87 g NaCl với H2SO4 đặc, dư thu được bao nhiêu lít khí ở đktc và bao nhiêu gam muối Na2SO4, biết hiệu suất của phản ứng là H= 90%.
Lời giải:
2NaCl + H2SO4 → Na2SO4 + 2HCl
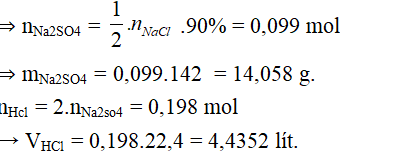
Bài 3. Cho 31,6 g KMnO4 tác dụng với dung dịch HCl dư sẽ thu được bao nhiêu lít Cl2 (ở đktc) nếu H của phản ứng là 75%.
Lời giải:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
nKMnO4 = 31,6/ 158 = 0,2 mol
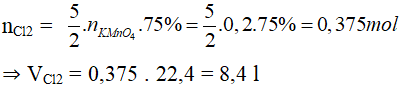
Bài 4. Cho 0,896 lít Cl2 tác dụng với 200 ml dung dịch NaOH 1M ở to thường thu được dung dịch X. Tính CM của các chất trong dung dịch X ?
Lời giải:
Cl2 + 2NaOH → NaCl + NaClO + H2O
nCl2 = 0,896/22,4 = 0,04 mol
nNaOH = 0,2 mol
Theo pt ⇒ nNaCl = nNaClO = nCl2 =0,04 mol
⇒ CMNaCl = CMNaClO = 0,04/0,2 = 0,2M
nNaOHdư = 0,2 – 0,04.2 = 0,12 mol ⇒ CMNaOH = 0,12 / 0,2 = 0,6M
B. Bài tập trắc nghiệm
Câu 1. Cho 17,4 gam MnO2 tác dụng hết với HCl lấy dư. Toàn bộ khí clo sinh ra được hấp thụ hết vào 148,5 gam dung dịch NaOH 20% (ở nhiệt độ thường) tạo ra dung dịch A. Vậy dung dịch A có các chất và nồng độ % tương ứng như sau:
A. NaCl 10% ; NaClO 5%
B. NaCl 7,31%; NaClO 6,81%, NaOH 6%
C. NaCl 7,19%; NaClO 9,16%, NaOH 8,42%
D. NaCl 7,31%; NaClO 9,31%, HCl 5%
Lời giải:
Đáp án: C

Câu 2. Hidro clorua bị oxi hóa bởi MnO2 biết rằng khí clo tạo thành trong phản ứng đó có thể đẩy được 12,7 gam iot từ dung dịch sodium iodide. Vậy khối lượng HCl là:
A. 7,3g B. 14,6g C. 3,65g D. 8,9g
Lời giải:
Đáp án: A
Phương trình phản ứng:
MnO2 + 4HCl → MnCl2 + Cl2 + H2O
0,2 0,05 mol
Cl2 + 2KI → 2KCl + I2
0,05 0,05
mHCl = 0,2 × 36,5 = 7,3g
Câu 3. Nguyên tố R là phi kim thuộc phân nhóm chính trong bảng tuần hoàn. Tỷ lệ % R trong oxit cao nhất với %R trong hợp chất khí với hidro là 0,5955. Vậy R là:
A. Flo B. Clo C. Brom D. Iot
Lời giải:
Đáp án: C
Gọi công thức của R với oxi là R2Ox (x = 4, 5, 6, 7)
Suy ra công thức của R với hidro là RH8 – x
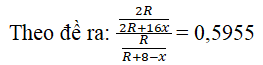
→ Rút ra được biểu thức liên hệ R và x
Sau đó biện luận ta được x = 7, R = 80 → R là Brom
Câu 4. Cho 19,05 gam hỗn hợp KF và KCl tác dụng hết với dung dịch H2SO4 đặc thu được 6,72 lít khí (đktc). Vậy % theo khối lượng của KF và KCl là:
A. 60,20% và 39,80% B. 60,89% và 39,11%
C. 39,11% và 60, 89% D. 70% và 30%
Lời giải:
Đáp án: B
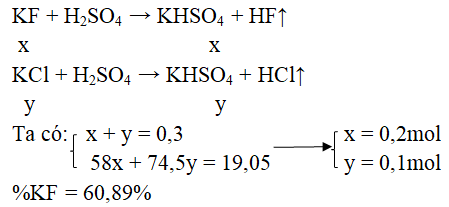
Câu 5. Dung dịch A chứa đồng thời axit HCl và H2SO4. Để trung hòa 40 ml A cần dùng vừa hết 60 ml NaOH 1M. Cô cạn dung dịch khi trung hòa, thu được 3,76 g hỗn hợp muối khan. Vậy nồng độ mol/l của hai axit HCl và H2SO4 là:
A. 1 và 0,75 B. 0,25 và 1 C. 0,25 và 0,75 D. 1 và 0,25
Lời giải:
Đáp án: D
Gọi a, b là nồng độ mol của HCl và H2SO4
HCl + NaOH → NaCl + H2O
0,04a 0,04a 0,04a
H2SO4 + 2NaOH → Na2SO4 + 2H2O
0,04b 0,08b 0,04b
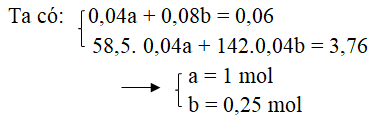
Câu 6. Khi đun nóng muối kali clorat, không có xúc tác, thì muối này bị phân hủy đồng thời theo hai phương trình sau đây:
2KClO3 → 2KCl + 3O2 (1)
4KClO3 → 3KClO3 + KCl (2)
Biết rằng khi phân hủy hoàn toàn 73,5 gam kali clorat thì thu được 33,5 gam potassium chloride. Vậy phần trăm khối lượng KClO3 phân hủy theo (1) là:
A. 80,23% B. 83,25% C. 85,1% D. 66,67%
Lời giải:
Đáp án: D
Các phản ứng xảy ra:
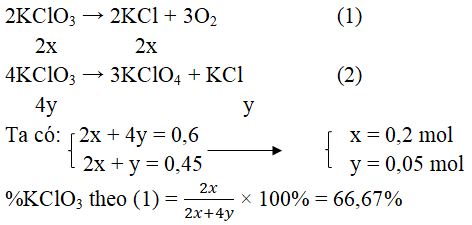
Thi online Hóa 10 KNTTThi online Hóa 10 CDThi online Hóa 10 CTST
Xem thêm các dạng bài tập Hóa học lớp 10 có trong đề thi Tốt nghiệp THPT khác:
Để học tốt lớp 10 các môn học sách mới:
- Giải bài tập Lớp 10 Kết nối tri thức
- Giải bài tập Lớp 10 Chân trời sáng tạo
- Giải bài tập Lớp 10 Cánh diều
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Lớp 10 - Kết nối tri thức
- Soạn văn 10 (hay nhất) - KNTT
- Soạn văn 10 (ngắn nhất) - KNTT
- Soạn văn 10 (siêu ngắn) - KNTT
- Giải sgk Toán 10 - KNTT
- Giải sgk Vật lí 10 - KNTT
- Giải sgk Hóa học 10 - KNTT
- Giải sgk Sinh học 10 - KNTT
- Giải sgk Địa lí 10 - KNTT
- Giải sgk Lịch sử 10 - KNTT
- Giải sgk Kinh tế và Pháp luật 10 - KNTT
- Giải sgk Tin học 10 - KNTT
- Giải sgk Công nghệ 10 - KNTT
- Giải sgk Hoạt động trải nghiệm 10 - KNTT
- Giải sgk Giáo dục quốc phòng 10 - KNTT
- Lớp 10 - Chân trời sáng tạo
- Soạn văn 10 (hay nhất) - CTST
- Soạn văn 10 (ngắn nhất) - CTST
- Soạn văn 10 (siêu ngắn) - CTST
- Giải Toán 10 - CTST
- Giải sgk Vật lí 10 - CTST
- Giải sgk Hóa học 10 - CTST
- Giải sgk Sinh học 10 - CTST
- Giải sgk Địa lí 10 - CTST
- Giải sgk Lịch sử 10 - CTST
- Giải sgk Kinh tế và Pháp luật 10 - CTST
- Giải sgk Hoạt động trải nghiệm 10 - CTST
- Lớp 10 - Cánh diều
- Soạn văn 10 (hay nhất) - Cánh diều
- Soạn văn 10 (ngắn nhất) - Cánh diều
- Soạn văn 10 (siêu ngắn) - Cánh diều
- Giải sgk Toán 10 - Cánh diều
- Giải sgk Vật lí 10 - Cánh diều
- Giải sgk Hóa học 10 - Cánh diều
- Giải sgk Sinh học 10 - Cánh diều
- Giải sgk Địa lí 10 - Cánh diều
- Giải sgk Lịch sử 10 - Cánh diều
- Giải sgk Kinh tế và Pháp luật 10 - Cánh diều
- Giải sgk Tin học 10 - Cánh diều
- Giải sgk Công nghệ 10 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 10 - Cánh diều
- Giải sgk Giáo dục quốc phòng 10 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

