Bài tập về tính chất hóa học, phương pháp điều chế Halogen chọn lọc, có đáp án
Bài viết tính chất hóa học, phương pháp điều chế Halogen với phương pháp giải chi tiết giúp học sinh ôn tập, biết cách làm bài tập tính chất hóa học, phương pháp điều chế Halogen.
Bài tập về tính chất hóa học, phương pháp điều chế Halogen chọn lọc, có đáp án
Thi online Hóa 10 KNTTThi online Hóa 10 CDThi online Hóa 10 CTST
A. Bài tập tự luận
Bài 1. Vì sao clo ẩm có tính tẩy trắng còn clo khô thì không?
Lời giải:
Cl + H2 O → HCl + HClO ( hypochlorous acid)
HClO có tính tẩy trắng
Bài 2. Viết 3 phương trình phản ứng chứng tỏ clo có tính oxi hóa, 2 phương trình phản ứng chứng tỏ clo có tính khử.
Lời giải:
3 phương trình phản ứng chứng tỏ Clo có tính oxi hóa:
2Na + Cl2 → 2NaCl
2Fe + 3Cl2 → 2FeCl3
H2 + Cl2 → 2HCl
2 phương trình phản ứng chứng tỏ Clo có tính khử:
Cl + H2 O → HCl+ HClO ( hypochlorous acid)
Cl2 + 2NaOH → NaCl + NaClO + H2 O
Bài 3. a) Từ MnO2 , HCl đặc, Fe hãy viết các phương trình phản ứng điều chế Cl2 , FeCl2 và FeCl3 .
b) Từ muối ăn, nước và các thiết bị cần thiết, hãy viết các phương trình phản ứng điều chế Cl2 , HCl và nước Javel .
Lời giải:
a, MnO2 + 4HCl → MnCl2 + Cl2 + 2H2 O
Fe + HCl → FeCl2 + H2 ↑
FeCl2 + 2Cl2 → 2FeCl3
b, 2NaCl + 2H2 O → H2 + 2NaOH + Cl2
Cl2 + H2 → 2HCl
Cl2 + NaOH → NaCl + NaClO + H2
Bài 4. Viết 1 phương trình phản ứng chứng tỏ axit HCl có tính oxi hóa, 1 phương trình phản ứng chứng tỏ HCl có tính khử.
Lời giải:
HCl có tính oxi hóa
Fe + 2HCl → FeCl2 + H2
HCl có tính khử
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2 O
Bài 5. Viết 3 phương trình phản ứng điều chế sắt (III) clorua.
Lời giải:
FeCl2 + 2Cl2 → 2FeCl3
2Fe + 3Cl2 → 2FeCl3
Fe2 O3 + 6HCl → 2FeCl3 + 3H2 O
Bài 6. Viết phương trình phản ứng xảy ra khi cho lần lượt các chất trong nhóm A {HCl, Cl2 } tác dụng với lần lượt các chất trong nhóm B {Cu, AgNO3 , NaOH, CaCO3 }.
Lời giải:
Với HCl:
Cu + HCl → không xảy ra
AgNO3 + HCl → AgCl↓ + H2 O
NaOH + HCl → NaCl + H2 O
CaCO3 + 2HCl → CaCl2 + CO2 ↑ + H2 O
Với Cl2
Cu + Cl2 → CuCl2
AgNO3 + Cl2 → không xảy ra
2NaOH + Cl2 → NaCl + NaClO + H2 O
CaCO3 + Cl2 → không xảy ra
Bài 7. Axit HCl có thể tác dụng những chất nào sau đây? Viết phản ứng xảy ra: Al, Mg(OH) 2 , Na2 SO4 , FeS, Fe2 O3 , Ag2 SO4 , K2 O, CaCO3 , Mg(NO3 ) 2 .
Lời giải:
2Al + 6HCl → 2AlCl3 + 3H2
Mg(OH) 2 + HCl → MgCl2 + H2 O
Na2 SO4 + HCl → không xảy ra
FeS + 2HCl → FeCl2 + H2S↑
Fe2 O3 + 6HCl → 2FeCl3 + 3H2 O
Ag2 SO4 + HCl → AgCl↓ + H2 SO4
K2 O + HCl → KCl + H2 O
CaCO3 + 2HCl → CaCl2 + CO2 ↑ + H2 O
Mg(NO3 ) 2 + HCl → không xảy ra
Bài 9: Cho dãy các chất sau, chất nào có khả năng tác dụng được với axit HCl? Viết phương trình hóa học của phản ứng xảy ra, ghi rõ điều kiện của phản ứng: Fe, FeCl2 , FeO, Fe2 O3 , Fe3 O4 , KMnO4 , Cu, AgNO3 , H2 SO4 , Mg(OH) 2 .
Lời giải:
Các chất có thể tác dụng với axit HCl là: Fe, FeO, Fe2 O3 , Fe3 O4 , KMnO4 , AgNO3 , Mg(OH) 2 .
PTHH:
Fe + 2HCl → FeCl2 + H2
FeO + 2HCl → FeCl2 + H2 O
Fe2 O3 + 6HCl → 2FeCl3 + 3H2 O
Fe3 O4 + 8HCl → FeCl2 +2FeCl3 + 4H2 O
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2 O
AgNO3 + HCl → AgCl + HNO3
Bài 10: Trong các hình vẽ mô tả cách thu khí clo sau đây, hình vẽ nào mô tả đúng cách thu khí clo trong phòng thí nghiệm? Giải thích?
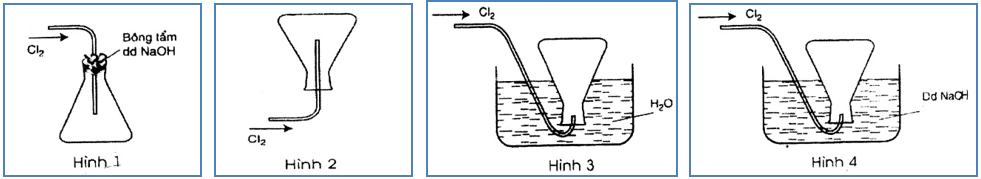
Đáp án: Hình 1.
Giải thích
- Do khí Cl2 nặng hơn không khí nên người ta để ngửa bình (Cl2 nặng hơn không khí sẽ nằm ở dưới nó đẩy không khí có chứa sẵn trong bình ra khỏi bình và chiếm chỗ).
- Dùng bông có tẩm dung dịch NaOH để cho không khí đi ra ngoài và khi bình đầy khí Cl2 thì Cl2 sẽ bị giữ lại trong bình không thoát ra ngoài được do 1 phần nó pứ với NaOH và phần này bị mất đi gọi là hao phí trong quá trình điều chế.
- Không sử dụng phương pháp đẩy nước do Cl tan trong nước.
Bài 11: Trong các hình vẽ sau, hình vẽ nào mô tả đúng nhất cách thu khí HCl trong phòng thí nghiệm?
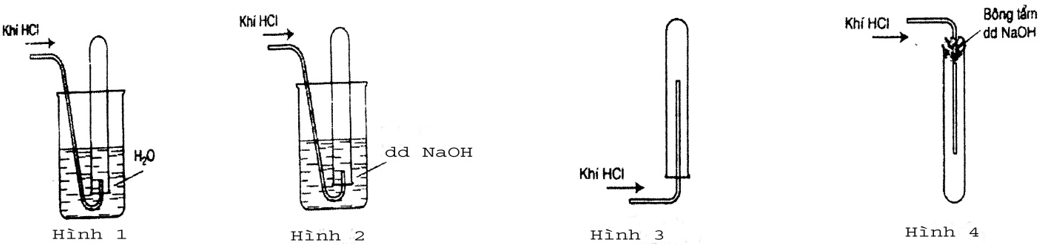
Đáp án Hình 4 (HD: Do HCl nặng hơn không khí nên để ngửa ống nghiệm. HCl tan nhiều trong nước nên không sử dụng phương pháp đẩy nước.)
Bài 12: Hãy giải thích: Vì sao người ta có thể điều chế hiđro clorua (HCl), hiđro florua (HF) bằng cách cho H2 SO4 đặc tác dụng với muối clorua hoặc florua. Nhưng không thể áp dụng phương pháp này để điều chế hiđro bromua (HBr), hoặc hiđro iotua (HI) ?
Lời giải:
Có thể điều chế HCl và HF bằng phản ứng :
2NaCl + H2 SO4 → Na2 SO4 + HCl
CaF2 + H2 SO4 → CaSO4 + 2HF
Nhưng không áp dụng phương pháp trên điều chế HBr và HI vì HBr và HI có tính khử mạnh có thể phản ứng ngay với H2 SO4 :
2HBr + H2 SO4 → Br2 + SO2 + 2H2 O
8HI + H2 SO4 → 4 I2 + H2 S + 4H2 O
Bài 13: Vì sao người ta có thể điều chế các halogen: Cl2 , Br2 , I2 bằng cách cho hỗn hợp H2 SO4 đặc và MnO2 tác dụng với muối clorua, bromua, iotua nhưng phương pháp này không thể áp dụng điều chế F2 ? Bằng cách nào có thể điều chế được flo (F2 ) ? Viết phương trình phản ứng điều chế Flo.
Lời giải:
Do F có tính oxi hóa rất mạnh nên phương pháp duy nhất để diều chế F là dùng dòng điện để oxi hóa ion F-trong florua nóng chảy (PP điện phân).
PTHH Điện phân hỗn hợp KF và HF:
2HF → H2 + F2
(KF)
Bài 14: Từ NaCl, MnO2 , H2 SO4 đặc, Zn, H2 O. Hãy viết phương trình hóa học để điều chế khí hiđroclorua và khí Clo bằng 2 cách khác nhau?
Lời giải:
MnO2 + 4HCl 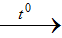
2NaCl + 2H2 O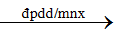
2NaCltt + H2 SO4 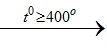
H2 + Cl2 → 2HCl
B. Bài tập trắc nghiệm
Câu 1: Trong tự nhiên, các halogen
A. chỉ tồn tại ở dạng đơn chất.
B. chỉ tồn tại ở dạng muối halogenua.
C. chỉ tồn tại ở dạng hợp chất.
D. tồn tại ở cả dạng đơn chất và hợp chất.
Lời giải:
Đáp án: C
Câu 2: Cho 4 đơn chất F2 ; Cl2 ; Br2 ; I2. Chất có nhiệt độ sôi cao nhất là :
A. F2. B. Cl2. C. Br2. D. I2.
Lời giải:
Đáp án: D
Câu 3: Halogen ở thể rắn (điều kiện thường), có tính thăng hoa là :
A. flo. B. clo. C. brom. D. iot.
Lời giải:
Đáp án: D
Câu 4: Hãy chỉ ra mệnh đề không chính xác :
A. Tất cả muối AgX (X là halogen) đều không tan trong nước.
B. Tất cả các hiđro halogenua đều tồn tại ở thể khí, ở điều kiện thường.
C. Tất cả các hiđro halogenua khi tan vào nước đều cho dung dịch axit.
D. Các halogen (từ F2 đến I2) tác dụng trực tiếp với hầu hết các kim loại.
Lời giải:
Đáp án: A
Câu 5: Dãy nào được xếp đúng thứ tự tính axit và tính khử giảm dần ?
A. HCl, HBr, HI, HF. B. HI, HBr, HCl, HF.
C. HCl, HI, HBr, HF. D. HF, HCl, HBr, HI.
Lời giải:
Đáp án: B
Câu 6: Sục Cl2 vào nước, thu được nước clo màu vàng nhạt. Trong nước clo có chứa các chất là :
A. Cl2, H2O. B. HCl, HClO.
C. HCl, HClO, H2O. D. Cl2, HCl, HClO, H2O.
Lời giải:
Đáp án: D
Câu 7: Trong PTN, Cl2 thường được điều chế theo phản ứng :
HCl đặc + KMnO4 → KCl + MnCl2 + Cl2 + H2O
Hệ số cân bằng của HCl là :
A. 4. B. 8. C. 10. D. 16.
Lời giải:
Đáp án: D
16HCl đặc + 2KMnO4 → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Câu 8: Trong phòng thí nghiệm người ta thường điều chế clo bằng cách
A. điện phân nóng chảy NaCl.
B. điện phân dung dịch NaCl có màng ngăn.
C. phân huỷ khí HCl.
D. cho HCl đặc tác dụng với MnO2 ; KMnO4…
Lời giải:
Đáp án: D
16HCl đặc + 2KMnO4 → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
4HCl + MnO2 → Cl2 + MnCl2 + 2H2O
Câu 9: Cho các phản ứng sau :
(a) 4HCl + PbO2 → PbCl2 + Cl2 + 2H2O
(b) HCl + NH4HCO3 → NH4Cl + CO2 + H2O
(c) 2HCl + 2HNO3 → 2NO2 + Cl2 + 2H2O
(d) 2HCl + Zn → ZnCl2 + H2
Số phản ứng trong đó HCl thể hiện tính khử là :
A. 2. B. 4. C. 1. D. 3.
Lời giải:
Đáp án: A
Các phản ứng trong đó HCl thể hiện tính khử là : a, c
Câu 10: Dãy nào được xếp đúng thứ tự tính axit giảm dần và tính oxi hoá tăng dần ?
A. HClO, HClO3, HClO2, HClO4. B. HClO4, HClO3, HClO2, HClO.
C. HClO, HClO2, HClO3, HClO4. D. HClO4, HClO2, HClO3, HClO.
Lời giải:
Đáp án: B
Câu 11: Clorua vôi, nước Gia-ven (Javel) và nước clo thể hiện tính oxi hóa là do
A. chứa ion ClO-, gốc của axit có tính oxi hóa mạnh.
B. chứa ion Cl-, gốc của hydrochloric acid điện li mạnh.
C. đều là sản phẩm của chất oxi hóa mạnh Cl2 với kiềm.
D. trong phân tử đều chứa cation của kim loại mạnh.
Lời giải:
Đáp án: A
Câu 12: Phương pháp duy nhất để điều chế Flo là :
A. Cho dung dịch HF tác dụng với MnO2.
B. Điện phân nóng chảy hỗn hợp NaF và NaCl.
C. Điện phân nóng chảy hỗn hợp KF và HF.
D. Cho Cl2 tác dụng với NaF.
Lời giải:
Đáp án: C
Thi online Hóa 10 KNTTThi online Hóa 10 CDThi online Hóa 10 CTST
Xem thêm các dạng bài tập Hóa học lớp 10 có trong đề thi Tốt nghiệp THPT khác:
Để học tốt lớp 10 các môn học sách mới:
- Giải bài tập Lớp 10 Kết nối tri thức
- Giải bài tập Lớp 10 Chân trời sáng tạo
- Giải bài tập Lớp 10 Cánh diều
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Lớp 10 - Kết nối tri thức
- Soạn văn 10 (hay nhất) - KNTT
- Soạn văn 10 (ngắn nhất) - KNTT
- Soạn văn 10 (siêu ngắn) - KNTT
- Giải sgk Toán 10 - KNTT
- Giải sgk Vật lí 10 - KNTT
- Giải sgk Hóa học 10 - KNTT
- Giải sgk Sinh học 10 - KNTT
- Giải sgk Địa lí 10 - KNTT
- Giải sgk Lịch sử 10 - KNTT
- Giải sgk Kinh tế và Pháp luật 10 - KNTT
- Giải sgk Tin học 10 - KNTT
- Giải sgk Công nghệ 10 - KNTT
- Giải sgk Hoạt động trải nghiệm 10 - KNTT
- Giải sgk Giáo dục quốc phòng 10 - KNTT
- Lớp 10 - Chân trời sáng tạo
- Soạn văn 10 (hay nhất) - CTST
- Soạn văn 10 (ngắn nhất) - CTST
- Soạn văn 10 (siêu ngắn) - CTST
- Giải Toán 10 - CTST
- Giải sgk Vật lí 10 - CTST
- Giải sgk Hóa học 10 - CTST
- Giải sgk Sinh học 10 - CTST
- Giải sgk Địa lí 10 - CTST
- Giải sgk Lịch sử 10 - CTST
- Giải sgk Kinh tế và Pháp luật 10 - CTST
- Giải sgk Hoạt động trải nghiệm 10 - CTST
- Lớp 10 - Cánh diều
- Soạn văn 10 (hay nhất) - Cánh diều
- Soạn văn 10 (ngắn nhất) - Cánh diều
- Soạn văn 10 (siêu ngắn) - Cánh diều
- Giải sgk Toán 10 - Cánh diều
- Giải sgk Vật lí 10 - Cánh diều
- Giải sgk Hóa học 10 - Cánh diều
- Giải sgk Sinh học 10 - Cánh diều
- Giải sgk Địa lí 10 - Cánh diều
- Giải sgk Lịch sử 10 - Cánh diều
- Giải sgk Kinh tế và Pháp luật 10 - Cánh diều
- Giải sgk Tin học 10 - Cánh diều
- Giải sgk Công nghệ 10 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 10 - Cánh diều
- Giải sgk Giáo dục quốc phòng 10 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

