Cách viết và cân bằng phương trình hóa học Nhóm Nitơ (hay, chi tiết)
Bài viết Cách viết và cân bằng phương trình hóa học Nhóm Nitơ với phương pháp giải chi tiết giúp học sinh ôn tập, biết cách làm bài tập Cách viết và cân bằng phương trình hóa học Nhóm Nitơ.
Cách viết và cân bằng phương trình hóa học Nhóm Nitơ (hay, chi tiết)
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
A. Phương pháp giải & Ví dụ minh họa
- Cân bằng phản ứng oxi hoá - khử theo phương pháp thăng bằng ion – electron cũng phải đảm bảo nguyên tắc: tổng electron mà chất khử cho bằng tổng electron mà chất oxi hoá nhận (như ở phương pháp thăng bằng electron).Chỉ khác là chất oxi hoá, chất khử viết dưới dạng ion.
Cần nhớ: Chất kết tủa (không tan), chất khí (chất dễ bay hơi), chất ít điện li (H2O) phải để dạng phân tử.
- Tuỳ theo môi trường phản ứng là axit, bazơ hoặc trung tính mà sau khi xác định nhường, nhận electron ta phải cân bằng thêm điện tích hai vế.
- Nếu phản ứng xảy ra trong môi trường axit, ta thêm H+ vào vế nào dư oxi, vế còn lại thêm H2O.
- Nếu phản ứng xảy ra trong môi trường bazơ, ta thêm OH- vào vế nào thiếu oxi, vế còn lại thêm H2O.
- Nếu phản ứng xảy ra trong môi trường nước thì nếu tạo axit ta cân bằng như môi trường axit, nếu tạo bazơ ta cân bằng như môi trường bazơ.
- Nhân hệ số cho hai quá trình nhường và nhận electron sao cho: số electron nhường ra của chất khử bằng số electron nhận vào của chất oxi hoá.
- Kiểm tra số nguyên tố ở hai vế.
Ví dụ minh họa
Bài 1: Cân bằng PTHH sau:
Cu + NaNO3 + H2SO4 → Cu(NO3)2 + NO + Na2SO4 + H2O
Lời giải:
| Quá trình oxi hóa: | 3x | Cu → Cu2+ + 2e |
| Quá trình khử: | 2x | NO3- + 3e + 4H+ → NO + 2H2O |
Phương trình dạng ion rút gọn:
3Cu + 2NO3- + 8H+ → 3Cu2+ + 2NO↑ + 4H2O
Phương trình dạng phân tử:
3Cu + 8NaNO3 + 4H2SO4 → 3Cu(NO3)2 + 2NO + 4Na2SO4 + 4H2O
Bài 2: Hoàn thành các phương trình hóa học giữa các chất sau.cho biết phản ứng nào thể hiện tính oxi hóa mạnh?phản ứng thể hiện tính axit.
a) HNO3 + NaOH
b) HNO3(l) + CuO
c) HNO3(l) + FeCO3
d) HNO3(đặc,nóng) + S
e) HNO3(đặc nóng) + Fe(OH)2
Lời giải:
a) HNO3 + NaOH → NaNO3 + H2O
b) 2HNO3 + CuO → Cu(NO3)2 + H2O
c) 10HNO3 loãng + 3FeCO3 → 3Fe(NO3)3 + 3CO2 + NO + 5H2O
d) 6HNO3 đặc + S −tº→ H2SO4 + 6NO2 + 2H2O
e) 4HNO3 đặc + Fe(OH)2 −tº→ Fe(NO3)3 + NO2 + 3H2O
- PƯ thể hiện tính acid của HNO3: a, b.
- PƯ thể hiện tính OXH của HNO3: c, d, e.
B. Bài tập trắc nghiệm
Bài 1: Cho các phản ứng sau :
(1) Cu(NO3)2 −tº→ (2) NH4NO2 −tº→
(3) NH3 + O2 −tº→ (4) NH3 + Cl2 −tº→
(5) NH4Cl −tº→ (6) NH3 + CuO −tº→
Trong các phản ứng trên, những phản ứng tạo ra khí N2 là
A. (2),(4),(6). B. (3),(5),(6).
C. (1),(3),(4). D. (1),(2),(5).
Lời giải:
Đáp án: A
(2) NH4NO2 −tº→ N2 + 2H2O
(4) 2NH3 + 3Cl2 → N2 + 6HCl
(6) NH3 + CuO −tº→ Cu + N2 + H2O7
Bài 2: Cho các phản ứng sau :
(1) NH4Cl −tº→ (2) NH4NO3 −tº→
(3) NH4NO2 + NaOH −tº→ (4) Cu + HCl + NaNO3 −tº→
(5) (NH4)2CO3 −tº→
Trong các phản ứng trên, số phản ứng tạo thành khí NH3 là
A. 2. B. 3. C. 4. D. 5.
Lời giải:
Đáp án: B
(1) NH4Cl −tº→ NH3 + HCl
(3) NH4NO2 + NaOH −tº→ NaNO2 + NH3 + H2O
(5) (NH4)2CO3 −tº→ 2 NH3 +CO2 + H2O
Bài 3: Cho 2 muối X, Y thỏa mãn điều kiện sau:
X + Y → không xảy ra phản ứng.
X + Cu → không xảy ra phản ứng.
Y + Cu → không xảy ra phản ứng.
X +Y + Cu → xảy ra phản ứng.
X và Y là:
A. Mg(NO3)2 và KNO3 B. Fe(NO3)3 và NaHSO4.
C. NaNO3 và NaHCO3 D. NaNO3 và NaHSO4.
Lời giải:
Đáp án: D
Bài 4: Cho sơ đồ chuyển hóa : P2O5 −+KOH→ X −+H2PO4→ Y −+KOH→ Z.
Các chất X, Y, Z lần lượt là:
A. KH2PO4, K2HPO4, K3PO4 B. KH2PO4, K3PO4, K2HPO4
C. K3PO4, KH2PO4, K2HPO4 D. K3PO4, K2HPO4, KH2PO4
Lời giải:
Đáp án: C
Bài 5: Trong các phản ứng sau, phản ứng nào NH3 đóng vai trồ là chất oxi hóa ?
A. 2NH3 + H2O2 +MnSO4 → MnO2 + (NH4)2SO4
B. 2NH3 + 3Cl2 → N2 + 6HCl
C. 4NH3 + 5O2 → 4NO + 6H2O
D. 2NH3 + 2 Na → 2NaNH2 + H2
Lời giải:
Đáp án: D
Bài 6: Tính tổng hệ số cân bằng của phản ứng sau:
Al + NaNO3 + NaOH + H2O → NaAlO2 + NH3
A. 29 B. 25 C. 21 D. 18
Lời giải:
Đáp án: A
8Al + 3NaNO3 + 5NaOH + 2 H2O → 8NaAlO2 + 3NH3
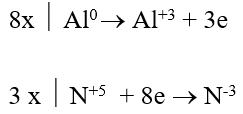
Bài 7: Cho Mg tác dụng với dd HNO3 loãng tạo khí N2O (là sản phẩm khử duy nhất). Tổng các hệ số trong phương trình hoá học là:
A. 18 B. 13 C. 24 D. 10
Lời giải:
Đáp án: C
4Mg + HNO3 → 5H2O + 4Mg(NO3)2 + N2O
C. Bài tập tự luyện
Câu 1: Tổng hệ số của các chất trong phản ứng: Fe3O4 + HNO3 → Fe(NO3)3 + NO + H2O là
A. 55.
B. 20.
C. 25.
D. 50.
Câu 2: Trong phản ứng: 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O. Số phân tử HNO3 đóng vai trò chất oxi hoá là
A. 8.
B. 6.
C. 4.
D. 2.
Câu 3: Trong phản ứng: FexOy + HNO3 → Fe(NO3)3 + N2 + H2O thì một phân tử FexOy sẽ
A. nhường (2y − 3x) electron.
B. nhận (3x − 2y) electron.
C. nhường (3x − 2y) electron.
D. nhận (2y − 3x) electron.
Câu 4: Trong các phản ứng sau, phản ứng nào NH3 đóng vai trò là chất oxi hóa?
A. 2NH3 + H2O2 +MnSO4 → MnO2 + (NH4)2SO4.
B. 2NH3 + 3Cl2 → N2 + 6HCl.
C. 4NH3 + 5O2 → 4NO + 6H2O.
D. 2NH3 + 2Na → 2NaNH2 + H2.
Câu 5: Khi nhỏ vài giọt NH3 đặc vào Cl2 lỏng, ta thấy có “khói trắng” bay ra. Khói trắng đó là hợp chất
A. NH4Cl.
B. NH4OH.
C. NCl3.
D. NCl5.
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Xem thêm các dạng bài tập Hóa học lớp 11 có trong đề thi Tốt nghiệp THPT khác:
- Dạng 1: Bài tập về tính chất hóa học và phương pháp điều chế N2, NH3, HNO3, muối nitrate
- Dạng 2: Phương pháp nhận biết các chất trong Nhóm Nitơ
- Dạng 4: Các dạng bài tập về Amoni
- Dạng 5: Các dạng bài tập về nitric acid
- Dạng 6: Nhiệt phân muối nitrate
- Dạng 7: Bài tập về axit phophoric
- Dạng 8: Bài tập về phân bón
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 11 Global Success
- Giải sgk Tiếng Anh 11 Smart World
- Giải sgk Tiếng Anh 11 Friends Global
- Lớp 11 - Kết nối tri thức
- Soạn văn 11 (hay nhất) - KNTT
- Soạn văn 11 (ngắn nhất) - KNTT
- Giải sgk Toán 11 - KNTT
- Giải sgk Vật Lí 11 - KNTT
- Giải sgk Hóa học 11 - KNTT
- Giải sgk Sinh học 11 - KNTT
- Giải sgk Lịch Sử 11 - KNTT
- Giải sgk Địa Lí 11 - KNTT
- Giải sgk Giáo dục KTPL 11 - KNTT
- Giải sgk Tin học 11 - KNTT
- Giải sgk Công nghệ 11 - KNTT
- Giải sgk Hoạt động trải nghiệm 11 - KNTT
- Giải sgk Giáo dục quốc phòng 11 - KNTT
- Giải sgk Âm nhạc 11 - KNTT
- Lớp 11 - Chân trời sáng tạo
- Soạn văn 11 (hay nhất) - CTST
- Soạn văn 11 (ngắn nhất) - CTST
- Giải sgk Toán 11 - CTST
- Giải sgk Vật Lí 11 - CTST
- Giải sgk Hóa học 11 - CTST
- Giải sgk Sinh học 11 - CTST
- Giải sgk Lịch Sử 11 - CTST
- Giải sgk Địa Lí 11 - CTST
- Giải sgk Giáo dục KTPL 11 - CTST
- Giải sgk Hoạt động trải nghiệm 11 - CTST
- Giải sgk Âm nhạc 11 - CTST
- Lớp 11 - Cánh diều
- Soạn văn 11 Cánh diều (hay nhất)
- Soạn văn 11 Cánh diều (ngắn nhất)
- Giải sgk Toán 11 - Cánh diều
- Giải sgk Vật Lí 11 - Cánh diều
- Giải sgk Hóa học 11 - Cánh diều
- Giải sgk Sinh học 11 - Cánh diều
- Giải sgk Lịch Sử 11 - Cánh diều
- Giải sgk Địa Lí 11 - Cánh diều
- Giải sgk Giáo dục KTPL 11 - Cánh diều
- Giải sgk Tin học 11 - Cánh diều
- Giải sgk Công nghệ 11 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 11 - Cánh diều
- Giải sgk Giáo dục quốc phòng 11 - Cánh diều
- Giải sgk Âm nhạc 11 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

