(3 dạng) bài tập về Peptit, Protein ôn thi Tốt nghiệp (có lời giải)
Với 3 dạng bài tập về Peptit, Protein ôn thi Tốt nghiệp có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập về Peptit, Protein.
(3 dạng) bài tập về Peptit, Protein ôn thi Tốt nghiệp (có lời giải)
Thi online Hóa 12 KNTTThi online Hóa 12 CDThi online Hóa 12 CTST
Peptit = các α – amino acid liên kết với nhau qua liên kết peptit ( - CO – NH - )
Protein = polypeptide
Dạng 1: Phản ứng tạo peptit
Phương pháp :
- amino acid đơn no có CTTQ : CnH2n+1NO2
+ Phản ứng tạo dipeptide : chứa 2 gốc α–amnoaxit, giải phóng 1 phân tử H2O
2CnH2n+1NO2 → C2nH4nN2O3 + H2O
+ Phản ứng tạo tripeptide : chứa 3 gốc α–amnoaxit, giải phóng 2 phân tử H2O
3CnH2n+1NO2 → C3nH6n – 1 N3O4 + 2H2O
+ Phản ứng tạo polypeptide : chứa m gốc α–amnoaxit, giải phóng (m-1) phân tử H2O
mCnH2n+1NO2 → Cm.nH2m.n – m +2 NmOm+1 +(m-1)H2O
- Định luật BTKL suy ra : mamino acid = mpeptit + mnước
- Peptit có n gốc α – amino acid ⇒ số đồng phân peptit = n!
Ví dụ 1 : dipeptide mạch hở X và tripeptide mạch hở Y đều được tạo nên từ một amino acid (no, mạch hở, trong phân tử chứa một nhóm –NH2 và một nhóm –COOH). Đốt cháy hoàn toàn 0,15 mol Y, thu được khối lượng CO2 và H2O bằng 82,35 gam. Đốt cháy hoàn toàn 0,1 mol X, sản phẩm thu được cho lội từ từ qua nước vôi trong dư, tạo ra m gam kết tủa. Giá trị của m là:
A. 40 gam B. 80 gam C. 60 gam D. 30 gam
Hướng dẫn giải :
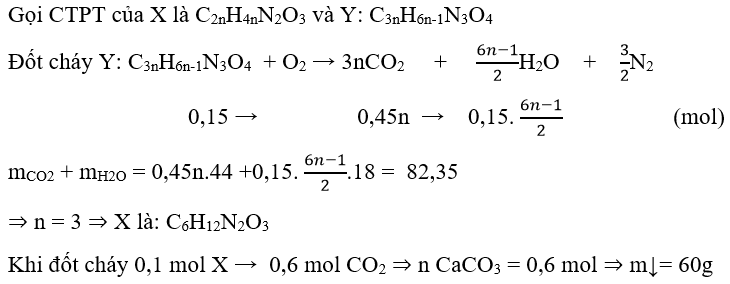
→ Đáp án C
Ví dụ 2 : Hỗn hợp X chứa 0,2 mol glycine và 0,1 mol alanine. Khối lượng dipeptide tối đa tạo thành là:
A. 27,72 B. 22,7 C. 22,1 D. 21,2
Hướng dẫn giải :
Tạo dipeptide ⇒ nH2O = ½ na.a = ½ (0,2 + 0,1) = 0,15 mol
Áp dụng định luật BTKL:
mdipeptide = mX – mH2O = 0,2.75 + 0,1.89 – 0,15.18 = 21,2g
→ Đáp án D
Dạng 2: Thủy phân peptit
Phương pháp :
- Phương trình phản ứng thủy phân hoàn toàn peptit (mạch hở) và protein.
+ Nếu thủy phân peptit ( mạch hở) và protein bằng enzim
H[NHRCO]nOH + (n-1) H2O → nH2NRCOOH
+ Nếu phản ứng thủy phân trong môi trường axit thì phản ứng như sau
H[NHRCO]nOH + (n-1) H2O + nHCl → nClH3NRCOOH
+ Nếu phản ứng thủy phân trong môi trường bazơ thì phản ứng như sau
H[NHRCO]nOH + nNaOH → nH2NRCOONa + H2O
Phương pháp giải bài tập về thủy phân peptit và protein chủ yếu là lập sơ đồ phản ứng ( chú ý tỉ lệ các chất) kết hợp với việc sử dụng định luật bảo toàn khối lượng. Khi gặp dạng bài tập thủy phân không hoàn toàn thì ta nên sử dụng định luật bảo toàn nguyên tố.
- Thủy phân peptit có n gốc α - amino acid thu được
Số dipeptide tối đa là : n – 1
Số tripeptide tối đa : n – 2
Số tetrepeptit tối đa : n – 3
Chú ý :
- Dựa vào phương trình thủy phân để tìm mối quan hệ số mol của các chất trong một phương trình phản ứng để xác định số mol hoặc loại peptit.
- M(n-peptit) = M(α-amino acid)×n - 18(n-1).
Ví dụ 1 : Cho 24,36 gam tripeptide mạch hở Gly-Ala-Gly tác dụng với lượng dung dịch HCl vừa đủ, sau phản ứng thu được dung dịch Y chứa m gam muối. Giá trị m là
A. 37,50gam
B. 41,82gam
C. 38,45gam
D. 40,42gam
Hướng dẫn giải :
Vì glycine và alanine đều chứa 1 nhóm -NH2 trong phân tử nên ta có:
nGly-Ala-Gly = 0,12 mol
Gly-Ala-Gly + 3HCl + 2H2O → muối
0,12 mol 0,36 mol 0,24 mol
mmuối = 24,36 + 36,5.0,36 + 18.0,24 = 41,82 gam
→ Đáp án B
Ví dụ 2 : Thủy phân hết m gam tetrapeptide Ala-Ala-Ala-Ala (mạch hở) thu được hỗn hợp gồm 28,48 gam Ala, 32 gam Ala-Ala và 27,72 gam Ala-Ala-Ala. Giá trị của m là
A. 90,6.
B. 111,74.
C. 81,54.
D. 66,44.
Hướng dẫn giải :
Lần lượt tính số mol các sản phẩm:
nAla = 28,48:89 = 0,32 mol; nAla-Ala = 32:160 = 0,2 mol;
nAla-Ala-Ala = 27,72:231 = 0,12 mol
Bảo toàn nguyên tố: Số mol gốc Ala trước và sau phản ứng bằng nhau.
Gọi nAla-Ala-Ala-Ala = a (mol). Trước phản ứng: ngốc (Ala) = 4.a
Sau phản ứng: ngốc (Ala) = 1. nAla + 2. nAla-Ala + 3. nAla-Ala-Ala
4a = 1. 0,32 + 2. 0,2 + 3. 0,12 → a = 0,27 mol
Vậy m = 302. 0,27 = 81,54 gam.
→ Đáp án C
Dạng 3: Nhận biết amin, amino acid, peptit - protein
Phương pháp :
Dùng những phản ứng có dấu hiệu đặc trưng, dễ quan sát
- Khi nhận biết có các amino acid ( đặc biệt các amino acid có số nhóm amin và số nhóm –COOH trong phân tử khác nhau) với nhau, hoặc amino acid với amin, nên sử dụng quỳ tím
- Các amin thơm, tính bazơ rất yếu nên không làm đổi màu quỳ tím
- Đối với protein, peptit ( trừ dipeptide) ta sử dụng phản ứng màu biuret – Cu(OH)2 hoặc HNO3
Ví dụ 1 : Dãy gồm các chất đều làm quỳ tím ẩm chuyển sang màu xanh là:
A. Amin, amonia, sodium hydroxide
B. aniline, methyl amin, amonia
C. methyl amin, amonia, sodium hydroxide
D. ammonium chloride, methyl amin, sodium hydroxide
Hướng dẫn giải :
→ Đáp án A: loại amin vì aniline là amin nhưng không làm quỳ tím hóa xanh
→ Đáp án B: loại aniline
→ Đáp án D: loại amoniclorua ( muối)
→ Đáp án C
Ví dụ 2 : Thuốc thử nào phân biệt được phenol và aniline?
A. Dung dịch Brom
B. Dung dịch NaOH
C. Dung dịch KCl
D. Cả A, B, C
Hướng dẫn giải :
→ Đáp án A: Dung dịch brom kết tủa với phenol và aniline
→ Đáp án B: phenol tan trong NaOH còn aniline thì không
→ Đáp án C: Không hiện tượng
→ Đáp án B
Ví dụ 3 : Để phân biệt 4 lọ mất nhãn đựng 4 dung dịch: glycerol, lòng trắng trứng, tinh bột, xà phòng có thể dùng lần lượt các thuốc thử nào sau đây?
A. Dung dịch iot, HNO3 đậm đặc và Cu(OH)2
B. HNO3 đậm đặc và Cu(OH)2
C. Dung dịch iot và Cu(OH)2
D. Dung dịch NaOH và Cu(OH)2
Hướng dẫn giải :
Dùng iot nhận ra tinh bột có màu tím, Cu(OH)2 tạo phức xanh lam với glycerol và phản ứng màu biore màu tím đặc trưng với lòng trắng trứng
→ Đáp án C
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Lớp 12 Kết nối tri thức
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT
- Lớp 12 Chân trời sáng tạo
- Soạn văn 12 (hay nhất) - CTST
- Soạn văn 12 (ngắn nhất) - CTST
- Giải sgk Toán 12 - CTST
- Giải sgk Vật Lí 12 - CTST
- Giải sgk Hóa học 12 - CTST
- Giải sgk Sinh học 12 - CTST
- Giải sgk Lịch Sử 12 - CTST
- Giải sgk Địa Lí 12 - CTST
- Giải sgk Giáo dục KTPL 12 - CTST
- Giải sgk Tin học 12 - CTST
- Giải sgk Hoạt động trải nghiệm 12 - CTST
- Giải sgk Âm nhạc 12 - CTST
- Lớp 12 Cánh diều
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

