Mô hình nguyên tử của Rơ-dơ-pho là gì (chi tiết nhất)
Bài viết Mô hình nguyên tử của Rơ-dơ-pho là gì lớp 7 chi tiết nhất là kiến thức có trong chương trình Khoa học tự nhiên 7 giúp học sinh nắm vững kiến thức trọng tâm về Mô hình nguyên tử của Rơ-dơ-pho.
Mô hình nguyên tử của Rơ-dơ-pho là gì (chi tiết nhất)
1. Mô hình nguyên tử của Rơ-dơ-pho
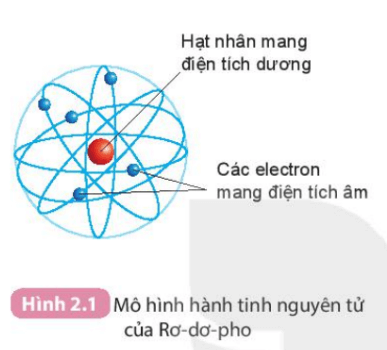
Rơ-dơ-pho (E. Rutherford) (1871 – 1937), nhà vật lí người Niu-di-lân (New Zealand), đã đề xuất mô hình nguyên tử. Theo mô hình này, nguyên tử có cấu tạo rỗng. Nguyên tử có hạt nhân ở tâm mang điện tích dương và các electron mang điện tích âm, chuyển động xung quanh hạt nhân như các hành tinh quay xung quanh Mặt Trời (mẫu hành tinh nguyên tử).
2. Kiến thức mở rộng
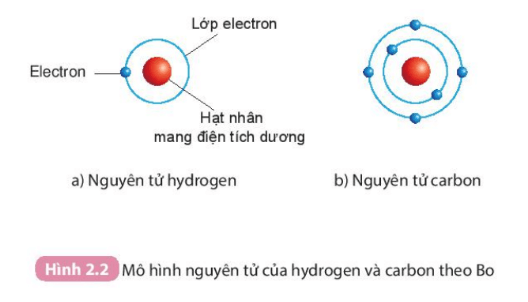
Bo (N. Bohr) (1885 – 1962), nhà vật lí người Đan Mạch, đã hoàn thiện mô hình nguyên tử của Rơ-dơ-pho. Theo Bo, các electron chuyển động xung quanh hạt nhân theo từng lớp khác nhau. Lớp electron trong cùng chứa tối đa 2 electron và bị hạt nhân hút mạnh nhất. Các lớp electron khác chứa tối đa 8 electron hoặc nhiều hơn và bị hạt nhân hút yếu hơn.
3. Bài tập minh họa
Câu 1: Theo Rutherford, phần lớn thể tích nguyên tử là:
A. hạt nhân đặc, chiếm toàn bộ thể tích.
B. rỗng, vì các electron chuyển động xung quanh hạt nhân.
C. do các proton tạo nên.
D. do neutron chiếm giữ.
Hướng dẫn giải
Đáp án B
Câu 2: Trong mô hình của Rutherford, các electron
A. đứng yên xung quanh hạt nhân.
B. chuyển động hỗn loạn bên trong hạt nhân.
C. chuyển động xung quanh hạt nhân như các hành tinh quay quanh Mặt Trời.
D. tồn tại theo lớp năng lượng cố định.
Hướng dẫn giải
Đáp án C
Câu 3: Nhược điểm chính của mô hình Rutherford là
A. không phát hiện ra neutron.
B. không giải thích được sự bền vững của nguyên tử.
C. không phát hiện ra electron.
D. chỉ đúng với các nguyên tử nặng.
Hướng dẫn giải
Đáp án B
Câu 4: Theo Bohr, các electron chuyển động
A. tự do bên trong nguyên tử.
B. trong các quỹ đạo bất kỳ.
C. theo những quỹ đạo tròn, gọi là các lớp năng lượng xác định.
D. trong một vùng không xác định gọi là đám mây electron.
Hướng dẫn giải
Đáp án C
Câu 5: Lớp electron trong cùng theo Bohr
A. bị hạt nhân hút yếu nhất.
B. chứa tối đa 8 electron.
C. chứa tối đa 2 electron và bị hút mạnh nhất.
D. không bị ảnh hưởng bởi hạt nhân.
Hướng dẫn giải
Đáp án C
Câu 6: Trong mô hình nguyên tử của Bohr, lực hút giữa electron và hạt nhân
A. không tồn tại.
B. tăng dần theo khoảng cách.
C. yếu hơn ở lớp trong.
D. mạnh nhất ở lớp gần hạt nhân, yếu dần khi ra xa.
Hướng dẫn giải
Đáp án D
Câu 7: Mô hình nguyên tử của Bohr khác mô hình của Rutherford ở điểm nào?
A. Phân chia vị trí electron theo lớp quỹ đạo xác định
B. Không có hạt nhân
C. Cho rằng nguyên tử không có cấu trúc rỗng
D. Electron đứng yên quanh hạt nhân
Hướng dẫn giải
Đáp án A
Câu 8: Điểm giống nhau giữa hai mô hình Rutherford và Bohr là:
A. Electron tồn tại tự do ngoài nguyên tử.
B. Cả hai đều mô tả nguyên tử không có hạt nhân.
C. Cả hai đều cho rằng electron chuyển động quanh hạt nhân.
D. Cả hai không thừa nhận electron có điện tích.
Hướng dẫn giải
Đáp án C
Xem thêm các bài viết về định nghĩa & khái niệm môn Hóa học hay, chi tiết khác:
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Lớp 12 Kết nối tri thức
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT
- Lớp 12 Chân trời sáng tạo
- Soạn văn 12 (hay nhất) - CTST
- Soạn văn 12 (ngắn nhất) - CTST
- Giải sgk Toán 12 - CTST
- Giải sgk Vật Lí 12 - CTST
- Giải sgk Hóa học 12 - CTST
- Giải sgk Sinh học 12 - CTST
- Giải sgk Lịch Sử 12 - CTST
- Giải sgk Địa Lí 12 - CTST
- Giải sgk Giáo dục KTPL 12 - CTST
- Giải sgk Tin học 12 - CTST
- Giải sgk Hoạt động trải nghiệm 12 - CTST
- Giải sgk Âm nhạc 12 - CTST
- Lớp 12 Cánh diều
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

