Sức điện động chuẩn là gì (chi tiết nhất)
Bài viết Sức điện động chuẩn là gì lớp 12 chi tiết nhất là kiến thức có trong chương trình Hóa học 12 giúp học sinh nắm vững kiến thức trọng tâm về Sức điện động chuẩn.
Sức điện động chuẩn là gì (chi tiết nhất)
1. Sức điện động chuẩn là gì?
- Sức điện động của pin đo ở điều kiện chuẩn gọi là sức điện động chuẩn. Sức điện động chuẩn có thể xác định dựa vào thế điện cực chuẩn của các cặp oxi hoá - khử tương ứng:
E° pin = E°cathode − E°anode
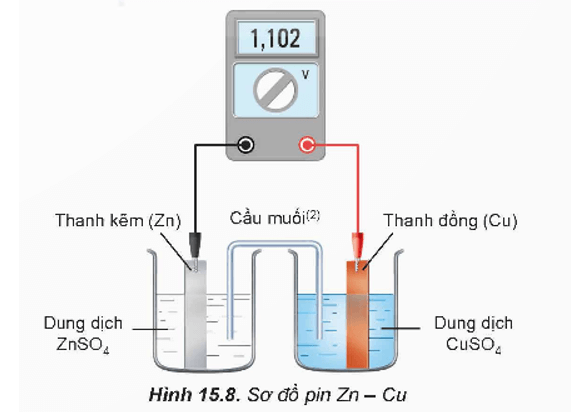
Ví dụ: đối với pin Zn - Cu:
Tại anode:
Zn → Zn2+ + 2e
Tại cathode:
Cu2+ + 2e → Cu
Epin = E°cathode - E°anode = 0,340 V - (-0,762 V) = 1,102 V.
2. Kiến thức mở rộng
2.1. Phản ứng oxi hoá - khử và dòng điện
Phản ứng oxi hoá - khử luôn kèm theo sự chuyển electron từ chất khử sang chất oxi hoá. Nếu các quá trình oxi hoá, quá trình khử xảy ra trên hai điện cực và electron được truyền từ chất khử sang chất oxi hoá qua dây dẫn thì năng lượng của phản ứng hoá học sẽ chuyển thành năng lượng điện.
2.2. Pin Galvani
Minh hoạ 1 pin Galvani:
Ở 25 °C, nhúng một thanh Zn vào cốc đựng dung dịch ZnSO4 1 M, nhúng một thanh Cu vào cốc đựng dung dịch CuSO4 1 M. Nối thanh Zn và thanh Cu bằng dây dẫn, lắp một vôn kế để đo hiệu điện thế. Đóng kín mạch bằng một cầu muối.
- Ở thanh Zn xảy ra quá trình: Zn → Zn2+ + 2e
Thanh Zn trở thành nguồn cung cấp electron nên đóng vai trò là cực âm (anode). Các electron theo dây dẫn di chuyển sang điện cực Cu.
- Ở thanh Cu xảy ra quá trình: Cu2+ + 2e → Cu
Điện cực Cu là nơi nhận electron nên đóng vai trò là cực dương (cathode).
- Trong pin Zn - Cu xảy ra quá trình oxi hoá và quá trình khử trên các điện cực, nghĩa là xảy ra phản ứng oxi hoá - khử: Zn + Cu2+ → Zn2+ + Cu
Phản ứng này giống như phản ứng xảy ra khi cho Zn tác dụng trực tiếp với dung dịch CuSO4. Việc bố trí tách biệt hai cặp oxi hoá - khử ở hai điện cực tạo ra sự truyền electron từ chất khử sang chất oxi hoá qua dây dẫn để tạo ra dòng điện.
- Trong quá trình pin hoạt động, cầu muối cho phép các ion di chuyển qua, do đó vừa đóng kín mạch điện, vừa duy trì tính trung hoà điện của mỗi dung dịch.
3. Bài tập minh họa
Câu 1. Cho pin điện hóa Pb – Cu có sức điện động chuẩn = 0,47 V, pin Zn – Cu có sức điện động chuẩn = 1,10 V. Sức điện động chuẩn của pin Zn – Pb là
A. 0,63 V.
B. 1,57 V.
C. 0,47 V.
D. 0,55 V.
Hướng dẫn giải
Đáp án đúng là: A
Ta có: =
=
⟹ = (V).
Vậy sức điện động chuẩn của pin Zn – Pb là 0,63 V.
Câu 2. Trong quá trình hoạt động của pin điện Ni − Cu, quá trình xảy ra ở anode là
A. Ni ⟶ Ni2+ + 2e.
B. Cu ⟶ Cu2+ + 2e.
C. Cu2+ + 2e ⟶ Cu.
D. Ni2+ + 2e ⟶ Ni.
Hướng dẫn giải
Đáp án đúng là: A
Trong pin điện hóa Ni − Cu thì cực âm là Ni (anode) xảy ra quá trình oxi hóa: Ni ⟶ Ni2+ + 2e.
Câu 3. Cho Pin điện hoá Al – Pb. Biết ; . Sức điện động của Pin điện hoá Al – Pb là
A. 1,79V.
B. −1,79V.
C. −1,53V.
D. 1,53V.
Hướng dẫn giải
Đáp án đúng là: D
= − = – 0,13 – (–1,66) = 1,53 V.
Câu 4. Cho một pin điện hóa được tạo bởi cặp oxi hóa – khử Fe2+/Fe và Ni2+/Ni. Phản ứng xảy ra ở cực âm của pin điện hóa (ở điều kiện chuẩn) là
A. Fe → Fe2+ + 2e.
B. Ni → Ni2+ + 2e.
C. Fe2+ + 2e → Fe.
D. Ni2+ + 2e → Ni.
Hướng dẫn giải
Đáp án đúng là: A
Cực âm (anode) là điện cực của Fe, xảy ra quá trình oxi hóa: Fe → Fe2+ + 2e.
Câu 5. Cho pin điện hóa Al – Cu. Biết = –1,66 V và = 0,34 V. Sức điện động chuẩn của pin điện hóa Al – Cu là
A. 1,00 V.
B. 1,34 V.
C. 1,66 V.
D. 2,00 V.
Hướng dẫn giải
Đáp án đúng là: D
Sức điện động chuẩn của pin điện hóa Al – Cu:
= – = 0,34 – (–1,66) = 2,00 (V).
Câu 6. Cho pin điện hóa Zn2+/Zn và Cu2+/ Cu. Biết = 0,34 V và = 0,76 . Sức điện động chuẩn của pin là
A. 1,0 V.
B. 1,3 V.
C. 1,6 V.
D. 1,1 V.
Hướng dẫn giải
Đáp án đúng là: D
.
Câu 7. Sức điện động chuẩn của pin Cu2+/ Cu và Ag+/ Ag là = 0,46V. Biết . Xác định thế điện cực chuẩn của cặp oxi hóa – khử Ag+/ Ag.
A. 1,2 V.
B. 1,4 V.
C. 0,9 V.
D. 0,8 V.
Hướng dẫn giải
Đáp án đúng là: D
Câu 8. Biết suất điện động chuẩn của pin điện hóa Cd – Mn là +0,79V và = –0,40V. Thế điện cực chuẩn là
A. 0,34 V.
B. 1,4 V.
C. 0,9 V.
D. 0,39 V.
Hướng dẫn giải
Đáp án đúng là: D
Xem thêm các bài viết về định nghĩa & khái niệm môn Hóa học hay, chi tiết khác:
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Lớp 12 Kết nối tri thức
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT
- Lớp 12 Chân trời sáng tạo
- Soạn văn 12 (hay nhất) - CTST
- Soạn văn 12 (ngắn nhất) - CTST
- Giải sgk Toán 12 - CTST
- Giải sgk Vật Lí 12 - CTST
- Giải sgk Hóa học 12 - CTST
- Giải sgk Sinh học 12 - CTST
- Giải sgk Lịch Sử 12 - CTST
- Giải sgk Địa Lí 12 - CTST
- Giải sgk Giáo dục KTPL 12 - CTST
- Giải sgk Tin học 12 - CTST
- Giải sgk Hoạt động trải nghiệm 12 - CTST
- Giải sgk Âm nhạc 12 - CTST
- Lớp 12 Cánh diều
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

