15+ Bài tập về Một số oxit quan trọng lớp 9 (có lời giải)
Tổng hợp trên 15 Bài tập về Một số oxit quan trọng Hóa học lớp 9 có lời giải chi tiết gồm các câu hỏi & bài tập trắc nghiệm đầy đủ các mức độ nhận biết, thông hiểu, vận dụng sẽ giúp học sinh biết cách làm bài tập Hóa 9.
15+ Bài tập về Một số oxit quan trọng lớp 9 (có lời giải)
Thi online KHTN 9 KNTTThi online KHTN 9 CDThi online KHTN 9 CTST
A/ Bài tập một số oxit quan trọng
Bài 1: Khi cho CaO vào nước thu được
A. dung dịch CaO.
B. dung dịch Ca(OH)2.
C. chất không tan Ca(OH)2.
D. cả B và C.
Lời giải
Khi cho CaO vào nước xảy ra phản ứng: CaO + H2O → Ca(OH)2
Vì Ca(OH)2 là chất ít tan trong nước, phần tan tạo thành dung dịch bazơ và còn 1 phần không tan lắng xuống
Đáp án: D
Bài 2: Ứng dụng nào sau đây không phải của canxi oxit?
A. Công nghiệp sản suất cao su
B. Sản xuất thủy tinh.
C. Công nghiệp xây dựng, khử chua cho đất.
D. Sát trùng diệt nấm, khử độc môi trường.
Lời giải
CaO được dùng trong công nghiệp sản xuất thủy tinh; khử chua đất trồng trọt; xử lí nước thải của các nhà máy.
=> Ứng dụng không phải của canxi oxit là: công nghiệp luyện kim
Đáp án: A
Bài 3: Hóa chất nào sau đây dùng để khử chua đất trong công nghiệp?
A. CaCO3
B. MgCO3
C. NaCl
D. CaO
Lời giải
Đất chua là đất có môi trường axit => dùng hóa chất có tính bazơ để trung hòa bớt độ chua của đất
CaO + H2O → Ca(OH)2 (môi trường bazơ)
Ca(OH)2 trung hòa lượng H+ trong đất làm đất bớt chua
Đáp án: D
Bài 4: Canxi oxit có thể tác dụng được với những chất nào sau đây?
A. H2O, CO2, HCl, H2SO4
B. CO2, HCl, NaOH, H2O
C. Mg, H2O, NaCl, NaOH
D. CO2, HCl, NaCl, H2O
Lời giải
Canxi oxit có thể tác dụng được với : H2O, CO2, HCl, H2SO4.
Đáp án: A
Bài 5: Các oxit tác dụng được với nước là
A. PbO2, K2O, SO3
B. BaO, K2O, SO2
C. Al2O3, NO, SO2
D. CaO, FeO, NO2
Lời giải
Các oxit tác dụng được với nước là BaO, K2O, SO2.
BaO + H2O → Ba(OH)2
K2O + H2O → 2KOH
SO2 + H2O ⇆ H2SO3
Đáp án: B
Bài 6: Để nhận biết hai chất rắn màu trắng CaO và P2O5 ta dùng:
A. nước và quỳ tím
B. dung dịch NaCl
C. dung dịch KOH
D. quỳ tím khô
Lời giải
Để nhận biết hai chất rắn màu trắng CaO và P2O5 ta dùng: nước và quỳ tím
- Cho 2 chất rắn vào nước => 2 chất rắn tan hết, tạo thành dung dịch
CaO + H2O → Ca(OH)2
P2O5 + 3H2O → 2H3PO4
- Cho quỳ tím vào 2 dung dịch thu được
+ dung dịch làm quỳ chuyển xanh là Ca(OH)2 => chất rắn ban đầu là CaO
+ dung dịch làm quỳ chuyển đỏ là H3PO4 => chất rắn ban đầu là P2O5
Đáp án: A
Bài 7: BaO tác dụng được với các chất nào sau đây?
A. H2O, NO, KOH
B. NaOH, SO3, HCl
C. P2O5, CuO, CO
D. H2O, H2CO3, CO2
Lời giải
BaO tác dụng được với: H2O, H2CO3, CO2.
BaO + H2O → Ba(OH)2
BaO + H2CO3 → BaCO3 + H2O
BaO + CO2 → BaCO3
Loại A vì BaO không phản ứng với KOH
Loại B vì BaO không phản ứng với NaOH
Loại C vì BaO không phản ứng với CO.
Đáp án: D
Bài 8: sulfur trioxide (SO3) tác dụng được với:
A. Nước, sản phẩm là bazơ
B. Axit, sản phẩm là bazơ
C. Nước, sản phẩm là axit
D. Bazơ, sản phẩm là axit
Lời giải
SO3 là acidic oxide
=> tác dụng với nước cho sản phẩm là axit và tác dụng với bazo cho sản phẩm là muối
Đáp án: C
Bài 9: Một loại đá vôi chứa 80% CaCO3. Nung 1 tấn đá vôi loại này có thể thu được bao nhiêu kg vôi sống (CaO), nếu hiệu suất là 85%?
A. 308,8 kg
B. 388,8 kg
C. 380,8 kg
D. 448,0 kg
Lời giải
1 tấn đá vôi chứa 80% CaCO3 => mCaCO3 = 0,8 tấn = 800 kg
CaCO3 → CaO + CO2
100 kg 56 kg
800 kg → 448 kg
Vì hiệu suất là 85% => mCaOthực tế = 448.85% = 380,8 kg
Đáp án: C
Bài 10: Từ 10 kg đá vôi ( không lẫn tạp chất) điều chế được bao nhiêu kg vôi sống, biết rằng hiệu suất toàn bộ quá trình là 75%?
Lời giải
CaCO3 → CaO + CO2↑
Theo phương trình 100(g) → 56 (g)
Hay 100 kg → 56 (kg)
Theo đề bài 10 kg → x (kg)
=> x = 10.56/100 = 5,6 (kg)
Vì H= 75% => lượng CaO thực tế thu được là: mCaO = 5,6. 75% : 100% = 4,2 (kg)
Đáp án: C
Bài 11: Hòa tan 0,56 gam CaO vào 800 ml nước thu được dung dịch nước vôi trong có nồng độ mol là
A. 0,15M
B. 0,0125M
C. 0,015M
D. 0,0025M
Lời giải
nCaO = 0,01 mol
CaO + H2O → Ca(OH)2
0,01 → 0,01
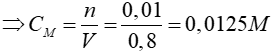
Đáp án: B
Bài 12: Để nhận biết hai khí SO2 và O2 ta dùng
A. quỳ tím ẩm
B. dung dịch Ca(OH)2
C. dung dịch Ba(OH)2
D. cả A, B, C đều đúng
Lời giải
Để nhận biết hai khí SO2 và O2 ta có thể dùng:
- Qùy tím ẩm: SO2 làm quỳ chuyển đỏ, O2 không đổi màu
- Dung dịch Ca(OH)2 hoặc Ba(OH)2: SO2 làm dung dịch xuất hiện vẩn đục, O2 không hiện tượng
Đáp án: D
Bài 13: Khí X là một khí có mùi hắc, khi dẫn khí X vào dung dịch nước vôi trong thì xuất hiện vẩn đục. Hỏi khí X là khí nào?
A. CO2
B. SO2
C. H2
D. H2S
Lời giải
X là một khí có mùi hắc, khi dẫn khí X vào dung dịch nước vôi trong thì xuất hiện vẩn đục → X là SO2 vì
SO2 + Ca(OH)2 → CaSO3 + H2O
Đáp án: B
Bài 14: Cho 8 gam sulfur trioxide (SO3) tác dụng với H2O, thu được 250 ml dung dịch axit sunfuric (H2SO4). Nồng độ mol của dung dịch axit thu được là
A. 0,1M
B. 0,4M
C. 0,5M
D. 0,6M
Lời giải
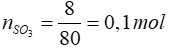
SO3 + H2O → H2SO4
0,1 → 0,1 mol
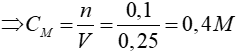
Đáp án: B
Bài 15: Hòa tan hết m gam SO3 vào nước thu được 98 gam dung dịch axit sunfuric có nồng độ 12,5%. Khối lượng m gam SO3 là:
A. 20g
B. 15g
C. 25g
D. 10g
Lời giải
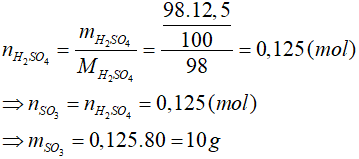
Đáp án: D
B/ Bài tập acidic oxide tác dụng với dung dịch kiềm
Bài 1: Cho 1,68 lít CO2 (đktc) sục vào bình đựng 250 ml dung dịch KOH dư. Biết thể tích dung dịch trước và sau phản ứng không thay đổi Nồng độ mol/lit của muối thu được sau phản ứng là
A. 0,2M B. 0,3M
C. 0,4M D. 0,5M
Lời giải
nCO2 = 0,075 mol
Vì KOH dư nên phản ứng tạo ra muối trung hòa
CO2 + 2KOH → K2CO3 + H2O
0,075 mol → 0,075 mol
Vì thể tích dung dịch trước và sau không thay đổi => Vdd = 250 ml = 0,25 lít
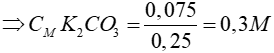
Đáp án cần chọn là: B
Bài 2: Dùng 400ml dung dịch Ba(OH)2 0,1M hấp thụ hoàn toàn V lít khí SO2 (đktc). Sau phản ứng thu được muối BaSO3 không tan. Giá trị bằng số của V là:
A. 0,896 lít B. 0,448 lít
C. 8,960 lít D. 4,480 lít
Lời giải
nBa(OH)2 = 0,04 mol
SO2 + Ba(OH)2 → BaSO3 + H2O
Tỉ lệ 1 1
Phản ứng ?mol 0,04 mol
Từ phương trình => nSO2= n Ba(OH)2 = 0,04 mol
=> VSO2 = nCO2 . 22,4 = 0,04 . 22,4 = 0,896 lít
Đáp án: A
Bài 3: Cho 11,2 lít CO2 vào 500 ml dung dịch NaOH 25% (D = 1,3 g/ml). Nồng độ mol/lit của dung dịch muối tạo thành là
A. 1M B. 2M
C. 2,5M D. 1,5M
Lời giải
nCO2 = 0,5 mol
+) Áp dụng công thức: mdd = D.V = 1,3.500 = 650 gam
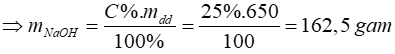
=> nNaOH = 4,0625 mol
Xét tỉ lệ: 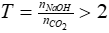
=> NaOH dư, CO2 hết, phản ứng thu được muối Na2CO3
CO2 + 2NaOH → Na2CO3 + H2O
0,5 mol → 0,5 mol
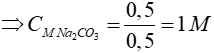
Đáp án: A
Bài 4: Dẫn 448 ml CO2 (đktc) sục vào bình chứa 100 ml dung dịch KOH 0,25M. Khối lượng hai muối tạo thành là
A. 0,85 gam và 1,5 gam. B. 0,69 gam và 1,7 gam.
C. 0,85 gam và 1,7 gam. D. 0,69 gam và 1,5 gam.
Lời giải
nCO2 = 0,02mol; nKOH = 0,025mol
Xét tỉ lệ: 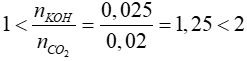
=> phản ứng tạo 2 muối K2CO3 (x mol) và KHCO3 (y mol)
CO2 + 2KOH → K2CO3 + H2O
x ← 2x ← x
CO2 + KOH → KHCO3
y ← y ← y
Theo PT ta có:
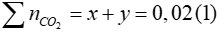
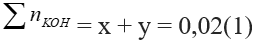
Từ (1) và (2) => x = 0,005 mol; y = 0,015 mol
=> mK2CO3 = 0,005.138 = 0,69gam; mKHCO3 = 0,015.100 = 1,5gam
Đáp án: D
Bài 5: Dẫn 22,4 lít khí CO2 ( đktc) vào 200g dung dịch NaOH 20%. Sau phản ứng tạo ra sản phẩm nào trong số các sản phẩm sau:
A. Muối natricarbonate và nước.
B. Muối natri hydrocarbon?t.
C. Muối natricarbonate.
D. Muối natrihiđrocarbonate và natricarbonate.
Lời giải
m chất tan NaOH = (m dd . C%):100% = 200 . 20%:100% = 40g
=> nNaOH = m NaOH : MNaOH = 40 : (23 + 16 + 1) = 1 mol
nCO2 = VCO2 : 22,4 = 22,4 : 22,4 = 1 mol
Ta có:
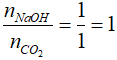
=> Phản ứng tạo muối axit: CO2 + NaOH → NaHCO3
Đáp án: B
Bài 6: Phải đốt bao nhiêu gam cacbon để khi cho khí CO2 tạo ra trong phản ứng trên tác dụng với 3,4 lít dung dịch NaOH 0,5M ta được 2 muối với muối hydrocarbon?t có nồng độ mol bằng 1,4 lần nồng độ mol của muối trung hoà.
A. 12,0 gam. B. 10,8 gam.
C. 14,4 gam. D. 18,0 gam.
Lời giải
Vì thể tích dung dịch không thay đổi nên tỉ lệ về nồng độ cũng chính là tỉ lệ về số mol.
Gọi 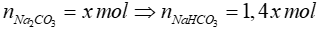
CO2 + 2NaOH → Na2CO3 + H2O
x ← 2x ← x
CO2 + NaOH → NaHCO3
1,4x ← 1,4x ← 1,4x
=> nNaOH = 2x + 1,4x = 1,7 => x = 0,5
=> nCO2 = x + 1,4x = 1,2 mol
C + O2 → CO2
=> nC = nCO2 = 1,2 mol
=> mC = 1,2.12 = 14,4 gam
Đáp án: C
Bài 7: Cho 4,48 lít CO2 (đktc) đi qua 190,48ml dung dịch NaOH 2% có khối lượng riêng là 1,05g/ml. Khối lượng muối tạo thành là
A. 16,8 gam. B. 8,4 gam.
C. 12,6 gam. D. 29,4 gam.
Lời giải
nCO2 = 0,2 mol;
+) Áp dụng công thức: mdd = D.V = 1,05.190,48 = 200 gam
=> mNaOH = 200.2% = 4 gam => nNaOH = 0,1 mol
Xét tỉ lệ: 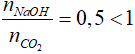
=> phản ứng chỉ tạo muối NaHCO3
CO2 + NaOH → NaHCO3
0,1 ← 0,1 → 0,1
=> mNaHCO3 = 0,1.84 = 8,4 gam
Đáp án: B
Bài 8: Dẫn 3,36 lít khí CO2 (đktc) vào 40g dung dịch NaOH 20%. Sản phẩm thu được sau khi cô cạn dung dịch và khối lượng tương ứng là:
A. 12,6 gam NaHCO3; 2,0 gam NaOH
B. 5,3 gam Na2CO3; 8,4 gam NaHCO3
C. 10,6 gam Na2CO3; 4,2 gam NaHCO3
D. 10,6 gam Na2CO3; 2,0 gam NaOH
Lời giải
nCO2 = vCO2: 22,4 = 3,36 : 22,4 = 0,15 mol
mNaOH = m dd. C% = 40.20% = 8 gam
nNaOH = 8:40 = 0,2 mol
Ta có:
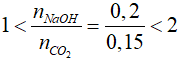
=> Tạo 2 muối Na2CO3 và NaHCO3
NaOH + CO2→ NaHCO3
x x ← x(mol)
2NaOH + CO2→Na2CO3+ H2O
2y y ← y(mol)
Có hệ phương trình:
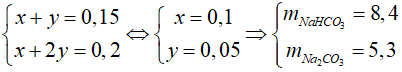
Đáp án: B
Bài 9: Thổi 2,464 lít khí CO2 vào một dung dịch NaOH thì được 9,46 gam hỗn hợp 2 muối Na2CO3 và NaHCO3. Nếu muốn chỉ thu được muối NaHCO3 thì cần thêm bao nhiêu lít khí carbonic nữa?
A. 0,336 lít. B. 0,112 lít.
C. 0,448 lít. D. 0,224 lít.
Lời giải
nCO2 = 0,11 mol
CO2 + NaOH → Na2CO3 + H2O
x 2x x
CO2 + NaOH → NaHCO3
y y y
Ta có hệ:
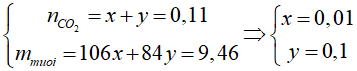
Ta có nNaOH = 2x + y = 0,12 mol
Để thu được NaHCO3 thì chỉ xảy ra phản ứng:
CO2 + NaOH → NaHCO3
=> nNaHCO3 = nCO2 = 0,12 mol
=> nCO2 cần thêm = 0,12 – 0,11 = 0,01 mol => cần thêm 0,224 lít khí CO2
Đáp án: D
Bài 10: Dẫn từ từ 3,136 lít khí CO2 (đktc) vào một dung dịch có hòa tan 12,8 gam NaOH sản phẩm thu được là muối Na2CO3. Khối lượng muối Na2CO3 thu được là:
A. 14,84 gam B. 18, 96 gam
C. 16,96 gam D. 16,44 gam
Lời giải
nCO2 =0,14 mol
nNaOH =0,32 mol
→ pư (1) có dư NaOH → nNa2CO3 = nCO2 =0,14 mol
→ mNa2CO3 = 14,84 g
Đáp án: A
Bài 11: Dẫn 1,12 lít khí SO2 (đktc) đi qua 700 ml dung dịch Ca(OH)2 0,1M. Khối lượng của muối thu được sau phản ứng là
A. 8 gam. B. 12 gam.
C. 6 gam. D. 9 gam.
Lời giải
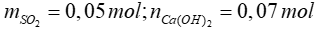
Xét tỷ lệ: 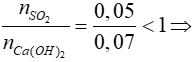 SO2 hết, Ca(OH)2 dư, phản ứng tạo muối CaSO3
SO2 hết, Ca(OH)2 dư, phản ứng tạo muối CaSO3
SO2 + Ca(OH)2 → CaSO3 + H2O
0,05 → 0,05 → 0,05
=> mCaSO3 = 0,05.120 = 6 gam
Đáp án: C
Bài 12: Cho 5,6 gam CaO vào nước tạo thành dung dịch A. Hấp thụ hoàn toàn 2,8 lít khí SO2 (đktc) vào dung dịch A thu được m gam kết tủa. Giá trị của m là
A. 9 gam. B. 3 gam.
C. 7 gam. D. 10 gam.
Lời giải
nCaO = 0,1 mol; nSO2 = 0,15 mol
CaO + H2O → Ca(OH)2
0,1 → 0,1 mol
Xét tỉ lệ: 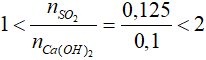
=> phản ứng sinh ra 2 muối CaSO3 (x mol) và Ca(HSO3)2 (y mol)
SO2 + Ca(OH)2 → CaSO3↓ + H2O
x ← x ← x
2SO2 + Ca(OH)2 → Ca(HSO3)2
2y ← y ← y
Từ PTHH ta có: ∑nSO2 = x + 2y = 0,125 (1)
∑nCa(OH)2 = x + y = 0,1 mol (2)
Từ (1) và (2) ta có hệ phương trình:
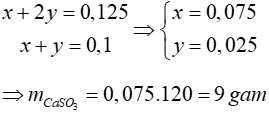
Đáp án: A
Bài 13: Cho 2,24 lít CO2 (đktc) tác dụng với dung dịch Ba(OH)2 dư. Khối lượng chất kết tủa thu được là :
A. 19,7 g B. 19,5 g
C. 19,3 g D. 19 g
Lời giải
nCO2 = V : 22,4 = 2,24 : 22,4 = 0,1 mol
Vì Ba(OH)2 dư do đó chỉ xảy ra phản ứng tạo kết tủa
PTHH: CO2 + Ba(OH)2 → BaCO3 + H2O
1 1
0,1 x
Từ pt ta có nBaCO3 = nCO2 = 0,1 mol
=> mBaCO3 = nBaCO3 . MBaCO3 = 0,1 . 197 = 19,7g
Đáp án: A
Bài 14: Hoà tan 2,8 gam CaO vào nước ta được dung dịch A. Nếu cho khí CO2 sục qua dung dịch A và sau khi kết thúc thí nghiệm thấy có 1 gam kết tủa thì có bao nhiêu lít CO2 đã tham gia phản ứng. Các thể tích khí đo ở đktc.
A. 0,224 lít. B. 3,360 lít.
C. 2,016 lít hoặc 0,224 lít. D. 2,24 lít hoặc 3,36 lít.
Lời giải
nCaO = 0,05 mol
1 gam kết tủa thu được là CaCO3 : 0,01 mol
CaO + H2O → Ca(OH)2
0,05 → 0,05 mol
TH1: CO2 phản ứng hết, Ca(OH)2 dư => phản ứng chỉ tạo muối CaCO3
CO2 + Ca(OH)2 → CaCO3↓ + H2O
0,01 ← 0,01
=> nCO2 = 0,01 mol => V = 0,224 lít
TH2: cả CO2 và Ca(OH)2 phản ứng hết tạo 2 muối CaCO3 và Ca(HCO3)2
CO2 + Ca(OH)2 → CaCO3↓ + H2O
0,01 ← 0,01 ← 0,01
2CO2 + Ca(OH)2 → Ca(HCO3)2
0,08 ← 0,04
=> nCO2 = 0,01 + 0,08 = 0,09 mol => VCO2 = 2,016 lít
Đáp án: C
Bài 15: Khử 16 gam Fe2O3 bằng CO dư, sản phẩm khí thu được cho đi vào dung dịch Ca(OH)2 dư thu được a gam kết tủa. Giá trị của a là :
A. 10 g B. 20 g
C. 30 g D. 40 g
Lời giải
= 16 : 160 = 0,1 mol
Fe2O3 + 3CO → 2Fe + 3CO2 (1)
1 3mol
0,1 ? mol
nCO2 = 0,3 mol
Do Ca(OH)2 dư => chỉ có phản ứng tạo thành kết tủa
CO2 + Ca(OH)2 CaCO3 + H2O (2)
1 1 mol
0,3 ? mol
Có nCO2 (2) = nCO2 (1) = 0,3 mol
=> nCaCO3 = 0,3 mol
=> a = mCaCO3 = nCaCO3 . MCaCO3 = 0,3 . 100 = 30g
Đáp án: C
..............................................................................
..............................................................................
Thi online KHTN 9 KNTTThi online KHTN 9 CDThi online KHTN 9 CTST
Xem thêm bộ câu hỏi trắc nghiệm Hóa học lớp 9 chọn lọc, có đáp án mới nhất hay khác:
- Bài tập về Tính chất hóa học của axit lớp 9 (có lời giải)
- Bài tập về Một số axit quan trọng lớp 9 (có lời giải)
- Bài tập về Tính chất hóa học của bazơ lớp 9 (có lời giải)
- Bài tập về Một số bazơ quan trọng lớp 9 (có lời giải)
- Bài tập về Tính chất hóa học của muối lớp 9 (có lời giải)
- Bài tập về Một số muối quan trọng lớp 9 (có lời giải)
Xem thêm các loạt bài Để học tốt Hóa học 9 hay khác:
- Giải bài tập Hóa học 9
- Giải sách bài tập Hóa 9
- Đề thi Hóa học 9
- Wiki 200 Tính chất hóa học
- Wiki 3000 Phản ứng hóa học quan trọng
Tủ sách VIETJACK luyện thi vào 10 cho 2k11 (2026):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài Chuyên đề: Lý thuyết - Bài tập Hóa học lớp 9 có đáp án được biên soạn bám sát nội dung chương trình sgk Hóa học 9.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 9 Global Success
- Giải sgk Tiếng Anh 9 Smart World
- Giải sgk Tiếng Anh 9 Friends plus
- Lớp 9 Kết nối tri thức
- Soạn văn 9 (hay nhất) - KNTT
- Soạn văn 9 (ngắn nhất) - KNTT
- Giải sgk Toán 9 - KNTT
- Giải sgk Khoa học tự nhiên 9 - KNTT
- Giải sgk Lịch Sử 9 - KNTT
- Giải sgk Địa Lí 9 - KNTT
- Giải sgk Giáo dục công dân 9 - KNTT
- Giải sgk Tin học 9 - KNTT
- Giải sgk Công nghệ 9 - KNTT
- Giải sgk Hoạt động trải nghiệm 9 - KNTT
- Giải sgk Âm nhạc 9 - KNTT
- Giải sgk Mĩ thuật 9 - KNTT
- Lớp 9 Chân trời sáng tạo
- Soạn văn 9 (hay nhất) - CTST
- Soạn văn 9 (ngắn nhất) - CTST
- Giải sgk Toán 9 - CTST
- Giải sgk Khoa học tự nhiên 9 - CTST
- Giải sgk Lịch Sử 9 - CTST
- Giải sgk Địa Lí 9 - CTST
- Giải sgk Giáo dục công dân 9 - CTST
- Giải sgk Tin học 9 - CTST
- Giải sgk Công nghệ 9 - CTST
- Giải sgk Hoạt động trải nghiệm 9 - CTST
- Giải sgk Âm nhạc 9 - CTST
- Giải sgk Mĩ thuật 9 - CTST
- Lớp 9 Cánh diều
- Soạn văn 9 Cánh diều (hay nhất)
- Soạn văn 9 Cánh diều (ngắn nhất)
- Giải sgk Toán 9 - Cánh diều
- Giải sgk Khoa học tự nhiên 9 - Cánh diều
- Giải sgk Lịch Sử 9 - Cánh diều
- Giải sgk Địa Lí 9 - Cánh diều
- Giải sgk Giáo dục công dân 9 - Cánh diều
- Giải sgk Tin học 9 - Cánh diều
- Giải sgk Công nghệ 9 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 9 - Cánh diều
- Giải sgk Âm nhạc 9 - Cánh diều
- Giải sgk Mĩ thuật 9 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

